微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将X、Y连接后插入Z的溶液中构成原电池,一段时间后X变细,Y上有气泡产生,则X、Y、Z 可能分别是(???)
A.Cu 、 Al 、CuSO4
B.Cu 、Ag 、AgNO3
C.Fe 、C、H2SO4
D.Cu 、C、HCl
参考答案:C
本题解析:题中X变细,Y上有气泡产生,说明X做负极,Y做正极,所以金属活泼性:X>Y,排除A选项;B选项中能构成原电池,但是正极上没有气体产生,故排除;C选项中Fe做负极,故反应一段时间后Fe变细,C做正极,电解质溶液是H2SO4,故C上有H2产生;D选项中的材料不能自发的构成氧化还原反应,故没有构成原电池
本题难度:简单
2、选择题 下列各装置中,不能构成原电池的是
[ ??? ]
A.
B.
C.
D.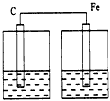
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( ?? )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
参考答案:C
本题解析:
试题分析:A、还原性的强弱与失去电子数目的数目多少无关,只决定于失去电子数目的难易程度,故A错误;B、阳离子的氧化性越强,对应单质的活泼性越差,故B错误;C、甲能与盐酸反应放出氢气,说明在金属活动性顺序表中,排在氢的前面,乙不能与盐酸反应放出氢气,在金属活动性顺序表中,排在氢的后面,故甲的活动性比金属乙强,故C正确;D、将甲、乙作电极构成原电池时,活泼的做负极,故活泼性乙大于甲,D错误;故选C。
本题难度:一般
4、填空题 (6分) 由A、B、C、D四种金属按下表中装置进行实验,根据实验现象回答①②③
参考答案:(6分)???2H+ +2e--==?H2↑;C→B;D>A
本题解析:
试题分析:金属A不断溶解,说明A是负极,失去电子,发生氧化反应,则A的金属性强于B的。其中正极是氢离子放电生成氢气,电极反应式是2H+ +2e--==?H2↑;C的质量增加,这说明C是正极,溶液中的铜离子放电,生成铜而形成,则电流方向是C→B,其中B的金属性强于C的;A和D构成原电池时,A上有气体产生,说明A是正极,溶液中的氢离子放电生成氢气,所以D的金属性强于A的。综上所述,四种金属的金属性强弱顺序是D>A>B>C。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传
本题难度:一般
5、选择题 以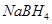 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是

A.该电池工作时Na+由a极区移向b极区
B.电极b是原电池的正极
C.该电池的负极反应为:
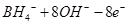 =
=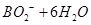
D.电路中通过6.02×1022个电子时,理论上消耗 mol
mol
参考答案:D
本题解析:
试题分析:B、H2O2具有强氧化性,易得电子,所以电极b为原电池的正极,正确;A、电池内部阳离子向正极移动,所以该电池工作时Na+由a极区移向b极区,正确;C、BH4-在负极上失去电子,生成BO2-,配平可得电极方程式:BH4-+8OH?—8e?= BO2-+6H2O,正确;D、根据化合价的变化可得H2O2与转移电子的对应关系:H2O2 ~2e?,所以电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol。
本题难度:简单