微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知NaHSO4在水中的电离方程式为NaHSO4 Na++H++S。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
Na++H++S。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
B.水电离出来的c(H+)=1×10-10 mol·L-1
C.c(H+)=c(OH-)+c(S)
D.该温度高于25 ℃
参考答案:C
本题解析:
试题分析:某温度下,pH=6的蒸馏水,KW=1×10-12,NaHSO4溶液的pH为2,c(H+)=1×10-2 mol·L-1,pH=12的NaOH溶液,c(OH-)="1" mol·L-1,反应后的溶液呈碱性。由NaHSO4 Na++H++S和H2O
Na++H++S和H2O H++OH-可知C正确。
H++OH-可知C正确。
考点:水的电离、溶液的pH
本题难度:一般
2、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:
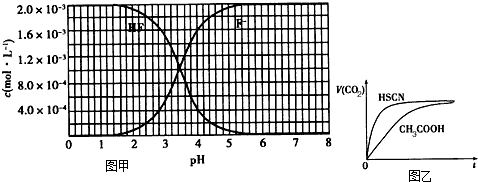
请根据以下信息回答下列问题:
(1)25℃时,将20mL0.10mol/LCH3COOH溶液和20mL0.10mol/LHSCN溶液分别与20mL0.10mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,②反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______.
参考答案:(1)①反应速率与氢离子浓度成正比,硫氰酸的电离平衡常数大于
本题解析:
本题难度:简单
3、选择题 已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是(?? )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:B
本题解析:由于HA中c(H+)="0.1" mol/L×0.1%=1×10-4 mol/L,因此pH=4,故A正确;由于弱电解质的电离过程为吸热过程,温度升高,电离平衡向正方向移动,从而使溶液中c(H+)增大,pH减小,故B错误;室温时0.1 mol/L HA溶液中c(H+)=c(A-)=1×10-4 mol/L,电离平衡常数:K=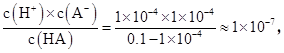 本题难度:一般
本题难度:一般
4、选择题 .向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,溶液的导电性(以电流I表示)和滴入的稀硫酸的体积(用V表示)间的关系正确的是:……………………………(??)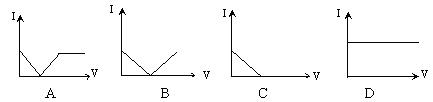
参考答案:A
本题解析:略
本题难度:简单
5、选择题 下列判断中,正确的是
A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B.25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3
参考答案:A
本题解析:
试题分析:已知25 ℃时NH4CN显碱性,说明CN-的水解能力大于NH4+的水解,NH3·H2O电离大于HCN,电离程度越大,电离常数越大,正确;B、Ksp只受温度影响,温度不变,Ksp不变,错误;C、新制氯水中有HCl、HClO,HCl是pH变色,但是HClO具有强氧化性,把有色物质漂白,因此pH试纸不能读出新制氯水的pH,错误;D、FeCl3溶液加热蒸干灼烧得到Fe2O3,Fe2(SO4)3溶液加热蒸干,灼烧得到Fe2(SO4)3,错误。
考点:考查弱电解质的电离平衡常数、Ksp、盐类水解等相关内容。
本题难度:一般