微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
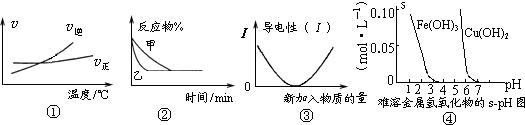
A.根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
参考答案:A、根据图象可知,温度升高,逆反应速率大于正反应速率,平衡向
本题解析:
本题难度:一般
2、实验题 (16分)某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
组别
| 草酸的体积(mL)
| 温度/℃
| 其他物质
|
?
| 2 mL
| 20
|
|
?
| 2 mL
| 20
| 10滴饱和MnSO4溶液
|
?
| 2 mL
| 30
|
|
④
| 1 mL
| 20
| 1 mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
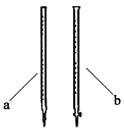
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
参考答案:Ⅰ.(1)①和② (2分);① 和 ③
(2
本题解析:
试题分析:Ⅰ.(1)如果研究催化剂对化学反应速率的影响需有对照实验,因此选①和②;如果研究温度对化学反应速率的影响需要其他因素相同做对照实验,因此选① 和 ③;(2)①和④中浓度不同, 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变。Ⅱ.(1)由于KMnO4本身是紫红色,无需再加指示剂;(2)KMnO4盛装在酸式滴定管中;(3)
5C2O42-+2MnO4-+16H+= 10CO2↑+2Mn2++8H2O
5 2
x 1500×10-3 ×0.200
x =7.5 ×10-3 a(Na2C2O4)=7.5 ×10-3×134/1.34=75%
考点: 不同条件对化学反应速率影响酸碱中和滴定相关知识。
本题难度:一般
3、填空题 一定条件下,A(g)+B(g)  C(g),ΔH <0,达到平衡后根据下列图像判断: C(g),ΔH <0,达到平衡后根据下列图像判断:
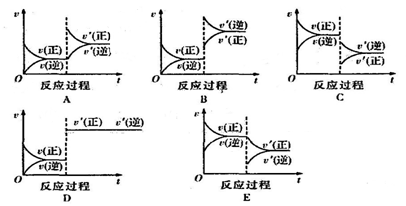
(1)升温,达到新平衡的是 (填“A、B、C、D或E”,下同)
新平衡中C的体积分数 (填“增大、减小或不变”,下同)
(2)减压,达到新平衡的是 ,A的转化率 。
(3)减少C的量,达到新平衡的是 。
(4)增加A的量,达到新平衡的是 ,此时B的转化率 ,A的转化率。
(5)使用催化剂,达到新平衡的是 ,C的质量分数。
参考答案:(1)B 减小 (2)C 减小 (3)E (4)A
本题解析:
试题分析:(1)升高温度,正逆反应速率瞬间加快,化学平衡向着吸热方向进行,即向着逆反应方向进行,逆反应速率大于正反应速率,产物C的体积分数减小,故答案为:B;减小;(2)降低压强,化学平衡向着气体系数和增大的方向进行,即向着逆反应方向进行,正逆反应速率减慢,反应物的转化率会减小,故答案为:C;减小;(3)减小C的量,即减小产物的浓度,平衡正向进行,正逆反应速率均减小,正反应速率大于逆反应速率,速率变化会在原来速率的基础上变化,故答案为:E;(4)增加A的量,即增大反应物的浓度,平衡正向进行,正反应速率大于逆反应速率,A本身转化率减小,另一种反应物B的转化率增大,故答案为:A;增大;减小;(5)使用催化剂,会同等程度的加快正逆反应速率,正逆反应速率仍然相等,但是平衡不移动,故答案为:D;不变;不变.
考点:影响反应速率的因素
本题难度:困难
4、选择题 用Fe与稀 反应制取 反应制取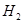 时,下列措施不能使 时,下列措施不能使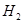 的生成速率加快的是(?? ) 的生成速率加快的是(?? )
A.加热
B.不用稀
C.滴加少量的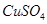
D.不用铁片,改用铁粉
参考答案:B
本题解析:
试题分析:在其它条件不变的情况下,升高温度或增大压强会增大反应物的接触面积或者借助于原电池反应等,均可以增大反应速率。浓硫酸和铁在常温下发生钝化,得不到氢气,所以答案选B。
点评:在判断浓度对反应速率的影响时,需要注意的是,在改变浓度的同时,不能改变反应的性质。
本题难度:一般
5、选择题 下列说法正确的是 (???)
A.活化分子相互碰撞即可发生化学反应
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C.某一反应的活化分子百分率是个定值
D.浓度增大使得反应物分子中的活化分子百分率增大
参考答案:B
本题解析:活化分子发生“有效碰撞”可发生化学反应,故A错误;随着外界条件的变化,活化分子百分率会发生变化,如:升温活化分子数增多,则活化分子百分率增大;加催化剂,改变反应路径,降低反应的活化能,则活化分子百分率增大;故C错误;比如开始分子有100个,百分比是20%,那活化分子数是20,现在增加浓度,从100到200,活化分子数从20到40,但是百分比还是20%,故D错误;故选B。
本题难度:一般
|