微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于浓硫酸的叙述中,正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸具有强氧化性,常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸具有脱水性,常用作气体的干燥剂
D.浓硫酸具有强氧化性,常温下能使铁、铝等金属表面形成氧化膜而钝化
参考答案:D
本题解析:
试题分析:A不正确,炭化利用的是浓硫酸的脱水性;B不正确,浓硫酸与铜反应需要加热;C不正确,浓硫酸作干燥剂,利用的是浓硫酸的吸水性,D正确,答案选D。
点评:该题是中等难度的试题,主要是考查学生对浓硫酸性质的熟悉掌握程度,有助于巩固学生的基础知识,提高学生的应试能力。该题需要注意的是在对硫酸性质的考查中,浓硫酸的三大特性是常考的知识点,尤其是浓硫酸的强氧化性。解题时应多角度分析,防止出现差错。
本题难度:简单
2、实验题 (15分)为研究硫酸的性质,研究性学习小组设计以下两个实验。实验一:检查好装置的气密性后,在如图一所示甲的试管中加入足量的Fe合金(含有一定量的C),然后,加入少量浓硫酸。
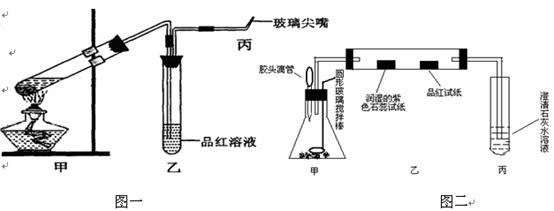
图一?????????????????????????????????????????图二
①.在未点燃酒精灯时,乙中没有明显现象,这是因为________________________???
为处理生成的有毒气体,还应在乙、丙之间接入干燥管,并在其中填充足量的????????。
②.反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
若甲中加入的是纯铁,丙处产生气体的速率没有前者的快,这是因为____________
实验二:
高一必修教材《浓硫酸与蔗糖反应的实验》这个传统实验是在敞口容器中进行,药品用量大,且浓硫酸与蔗糖反应过程中生成大量有毒气体直接排放到空气中,不符合“绿色化学”的新理念;对此实验进行新的设计和改进:取少量的蔗糖置于锥形瓶中加入几滴水,用胶头滴管滴加几滴浓硫酸,通过圆形玻璃搅拌棒不断搅拌;如上图二所示观察:
①.白色的蔗糖发黄再变黑,这是因为浓硫酸具有?????????????????性;一会儿迅速变成蜂窝状(形似“黑馒头” );写出发生的化学方程式:??????????????????????????????
②.紫色石蕊试纸变红,品红试纸褪色,澄清石灰水出现浑浊,该小组同学认为有二氧化碳生成,你是否赞成此观点;若赞成就不填写;若不赞成,你将如何改进才能证明有二氧化碳生成:????????????????????????????????????????????????????????????????????
③.另一小组将紫色石蕊试纸更换为少许无水硫酸铜,结果没有观察到无水硫酸铜变蓝,证明浓硫酸具有??????????;
参考答案:实验一
①常温下,Fe遇浓硫酸钝化(1分),而C不与浓
本题解析:略
本题难度:一般
3、选择题 精制蔗糖使之脱色,通常选用?????????????(???)
A.SO2漂白
B.Cl2漂白
C.Na2O2漂白
D.活性炭吸附
参考答案:D
本题解析:A 、B 不可,都有毒
C 不可,过氧化钠反应会生成氢氧化钠,有强腐蚀性,对人体有危害
D 可以,活性炭吸附既能脱色,对人体也没有危害。
本题难度:简单
4、选择题 根据某种共性,可将CO2、SO2归为同类氧化物。下列物质中,也属于这类氧化物的是:(??)
A.SO3
B.CaO
C.NO
D.NO2
参考答案:A
本题解析:由性质分析可知CO2、SO2均能与碱反应且产物只有盐和水,即为酸性氧化物,A也是酸性氧化物,B为碱性氧化物,而C与碱溶液不反应D与碱溶液发生氧化还原反应。答案选A。
本题难度:简单
5、实验题 (20分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题(由实验装置引起的实验误差忽略不计)。
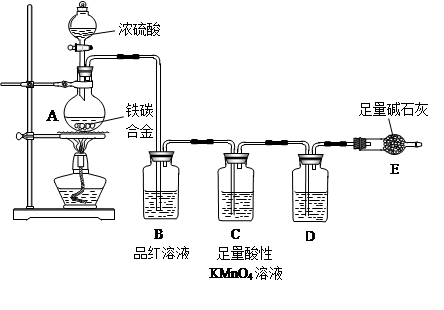
I. 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量;
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸;
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象:
写出A中发生反应的化学方程式___________________________________________(任写一个); B中的现象是________________________________________,由此可得到浓硫酸具有____________性;C中足量的酸性KMnO4溶液所起的作用是________________________;
D中盛放的试剂是_______________。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
___________________________________(任写一个)。
Ⅱ.测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,则铁碳合金中铁的质量分数为:___________________________________________(写表达式);
某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是_____________________________________________________________________;
(6)经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
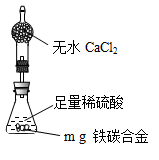
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量
参考答案:⑶2Fe+6H2SO4(浓) 本题解析:
本题解析:
试题分析:(3)浓硫酸具有强氧化性,能和铁或碳在加热的条件下反应,反应的化学方程式是2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓) 本题难度:一般
本题难度:一般