微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知硫化氢气体可与溴水反应生成硫,下图是用来制取硫化氢并比较硫元素、溴元素非金属性强弱的实验装置。
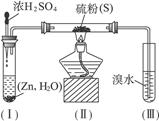
(1)将下列操作步骤补充完整:
①______________________________________________;
②用大火加热使硫沸腾与H2化合;
③______________________________________________;
④停止加热并做善后处理。
(2)装置(Ⅰ)中制氢气不直接用稀硫酸与锌反应,而将浓H2SO4滴入水中,其优点是__________________________________。
(3)装置(Ⅲ)中发生的现象是_______________________________,由此得出的结论是_____________________,反应的离子方程式为____________________________________。
参考答案:(1)①检查装置气密性,挤压胶头滴管使浓H2SO4滴入试管,
本题解析:由于H2S有毒,H2易燃易爆,因此操作的第一步应是检查装置气密性和检验H2的纯度,反应结束时,为防止(Ⅲ)内液体被倒吸,应先撤去导管再停止加热 。用浓H2SO4与用稀H2SO4的区别在于浓H2SO4有一个稀释的过程,其稀释时放出大量热,可以加快反应的进行。
本题难度:简单
2、实验题 根据下图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。答:???????????????????????????????????????????????????。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:?????????????????????????????。
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是????????????????????,作用是????????????????????。
B中加入的试剂是????????????????????,作用是????????????????????。
C中加入的试剂是????????????????????,作用是除尽????????????气体。
D中加入的试剂是????????????????????,作用是????????????????????。
(4)实验时,C中应观察到的现象是????????????????????????????????????。
参考答案:(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止
本题解析:本题的考点有:对较复杂的实验装置气密性的检查,用学过的化学知识检验浓H2SO4与木炭粉加热时得到的全部反应产物;同时通过对CO2的检验考查考生在进行化学实验时思维的严密性。
对实验装置的气密性检查是中学化学实验的基本要求之一,在本题中,由于装置比较大,双手的热量不足以使整个装置中气体膨胀,效果不显著,因而在B、C、D洗气瓶的导管口见不到气泡冒出,如果同学们明白检验装置气密性应用的原理,很容易会想到,在反应前用小火加热(或其他方法),使瓶内空气迅速膨胀,导致气泡从洗气瓶的导管中冒出,停止加热后,烧瓶冷
本题难度:简单
3、选择题 Cu粉放入稀H2SO4中,加热后也无明显现象,当加入一种盐后,Cu粉质量减少,而且溶液变蓝,同时有气体生成,此盐是
A.氯化物
B.硫酸盐
C.硝酸盐
D.磷酸盐
参考答案:C
本题解析:
试题分析:铜粉不会与稀硫酸反应,后面生成的溶液变蓝,证明有铜离子生成。应是加入了硝酸盐,铜与硝酸反应生成了硝酸铜溶液和一氧化氮气体。
点评:本题属于简单题,需要理解离子反应的本质,并熟练掌握常见物质的反应。
本题难度:一般
4、简答题 ?(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是????????????;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
参考答案:(15分)
(1)H(2分)
(2)H2O???
本题解析:
试题分析:(1)在周期表中X是原子半径最小的元素,所以X的元素符号是H;
(2)设Z的原子序数是x,则Y、W的原子序数分别是x-1、x+8,所以有x+x+8+x-1+1=32,解得x=8,Y、Z、W分别是N、O、S元素。O的非金属性强于S,所以Z、W形成的气态氢化物的稳定性H2O>H2S;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,则该强酸是硝酸,铜与稀硝酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O;
本题难度:一般
5、选择题 已知S、SO2、SO3三种物质的质量之比为2︰4︰5,它们的物质的量之比为
A.10︰5︰4
B.5︰4︰2
C.2︰4︰5
D.1︰1︰1
参考答案:D
本题解析:略
本题难度:简单