微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 两份等质量的铜片,一份直接与足量的质量分数为98.0%的浓硫酸(密度为1.84 g·cm-3)反应,另一份先制成氧化铜,再与足量的稀硫酸反应。结果两种方法得到的硫酸铜质量相等,消耗两酸的体积也相等。求浓、稀硫酸的物质的量浓度。?
参考答案:c(浓H2SO4)="18.4" m
本题解析:本题有多种解法,但须先求出浓H2SO4的物质的量浓度。为方便计算,设有浓H2SO4 1 L,则浓H2SO4的物质的量浓度为:
?c(浓H2SO4)=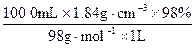 ?="18.4" mol·L-1
?="18.4" mol·L-1
下面是计算稀H2SO4物质的量浓度的两种方法。
方法1(一般解法):先求浓H2SO4的体积:
本题难度:简单
2、选择题 在含2molH2SO4的浓硫酸中加入足量的Zn粉,使其充分反应,则下列推断正确的是(???)
①放出的气体中除SO2外还有H2?②只放出SO2气体,其物质的量为1mol?③反应结束时转移的电子的物质的量为4mol
A.①
B.②
C.②③
D.①②
参考答案:A
本题解析:浓硫酸中硫元素是+6价,显氧化性,故还原产物是SO2:Zn+2H2SO4(浓)  ?ZnSO4+SO2↑+2H2O;而稀硫酸是H+显氧化性:Zn+H2SO4(稀)
?ZnSO4+SO2↑+2H2O;而稀硫酸是H+显氧化性:Zn+H2SO4(稀)  本题难度:简单
本题难度:简单
3、选择题 将装有50mL NO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是
A.5:3
B.3:5
C.2:5
D.3:2
参考答案:D
本题解析:利用差量法进行计算,设混合气体中NO2的体积为x
3NO2+H2O==2HNO3+NO ΔV
3??????????????? 1???? 2
x 50mL-30mL=20mL
3/x=2/20 ml x=30mL
则原混合气体中NO的体积为50mL-30mL=20mL
所以V(NO2) :V(NO)=30mL:20mL=3:2。
本题难度:困难
4、选择题 常温下,铁与下列酸溶液作用产生H2的是?????
A.浓硫酸
B.稀硫酸
C.浓硝酸
D.稀硝酸
参考答案:B
本题解析:A、C钝化,D、生成NO,只有B正确,选B。
本题难度:简单
5、实验题 某课外学习小组的同学设计了如图的装置,以验证SO?2的氧化性、还原性和漂白性。
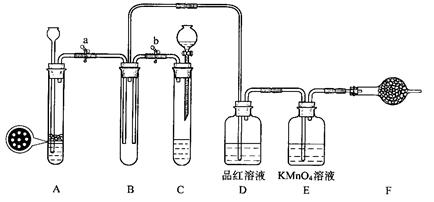
回答以下问题:
33.单独检查装置C的气密性的操作是,关闭活塞b,然后________________________,
若发现________________,说明装置C气密性良好。
34.用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是????????????????????????????????????????。
35.小组的同学在A、C装置中的另一个用FeS固体和稀硫酸制取H2S气体,反应的化学方程式为_________________??????????。
36.SO2气体通过D装置时现象是____________________??????,通过E装置时现象是
________________?;SO2与H2S在B装置中反应,现象是______________________。
37.F中盛有碱石灰,其作用是______________________。
参考答案:33.往试管中加水(1分);若水加不进去(1分)
34
本题解析:
试题分析:33.检查装置C的气密性,关闭活塞b,然后往试管中加水,若水加不进去说明装置C气密性良好。
34.因为Na2SO3是固体粉末,启普发生器隔板盛放不了,和硫酸溶液制取SO2气体,应选用分液漏斗和反应器做气体发生装置。
35.用FeS固体和稀硫酸制取H2S气体为FeS+H2SO4(稀)→ Fe SO4+H2S↑。
36.SO2气体有漂白作用,通过D装置时使品红褪色;SO2气体有还原性,通过E装置时使酸性高锰酸钾溶液褪色;SO2与H2S在B装置中反应:SO2+2H2S→3S+
本题难度:一般