微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 绿色化学的核心就是利用化学原理从源头上减少和清除工业生产对环境的污染。按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,这时原子的利用率为???????????????????。
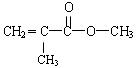 是甲基丙烯酸甲酯的结构简式。也可以写成CH2 = C(CH3)COOCH3。
是甲基丙烯酸甲酯的结构简式。也可以写成CH2 = C(CH3)COOCH3。
旧法合成它的反应是:
(CH3)2C = O+HCN (CH3)2C(OH)CN
(CH3)2C(OH)CN
(CH3)2C(OH)CN + CH3OH + H2SO4  ?CH2 = C(CH3)COOCH3+NH4HSO4
?CH2 = C(CH3)COOCH3+NH4HSO4
新法合成它的反应是:
CH3C ≡ CH + CO + CH3OH 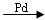 CH2= C(CH3)COOCH3
CH2= C(CH3)COOCH3
(1)与旧法相比,新法的突出优点是(??)
A.原料无爆炸危险
B.原料都是无毒物质
C.没有副产物,原子利用率高
D.对设备腐蚀性小
(2)计算:甲基丙烯酸甲酯旧法合成工艺的理论上原子利用率是?????????????。
(原子利用率=期望产物的总质量与生成物的总质量之比)
(3)写出聚甲基丙烯酸甲酯(又称有机玻璃)的结构简式???????????????????????????????。
参考答案:100% ,( C ), 46.5% 。 本题解析:略
本题解析:略
本题难度:简单
2、填空题 工业上合成氨的主要生产过程有:
(1)原料气的制备、净气和压缩。氮气来源于________,氢气来源于________,净化原料气的原因是__________________________________________________________。
(2)氨的合成。在________中进行,反应的最佳条件是_______________________________________________________________。
(3)氨的分离。如将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中通常含体积分数为15%左右的氨气,则出来的混合气体中含H2的体积分数为________,N2的体积分数为________。
参考答案:(1)空气 水和碳氢化合物 防止催化剂中毒
(2)合成
本题解析:(3)设起始N2、H2的体积分别为1、3,反应中转化的N2的体积为x,则
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始体积 1 3 0
平衡体积 1-x 3-3x ? 2x
依题意:
 本题难度:简单
本题难度:简单
3、填空题 (15分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
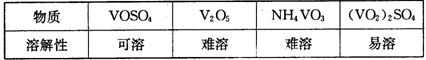
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下:
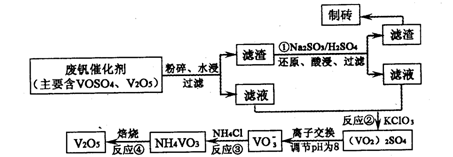
请回答下列问题。
⑴工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为????????????。
⑵反应①的目的是????????????????????????????????????????????????????????。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式:????????????????????????????????????????????????????????????。
⑷用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。
X为?????????????????????????(写化学式)。

⑸经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如上图所示。则NH4VO3在分解过程中?????????(填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
参考答案:⑴3V2O5+10Al6V+5Al2O3???⑵将V2O5转
本题解析:(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式表示为:
3V2O5+10Al6V+5Al2O3;
(2)由流程图可知反应①的目的是:将V2O5转化为可溶性的VOSO4;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,反应的离子方程式为:
NH+VO===NH4VO3↓;
(4)由质量守恒定律可知X为:H2O;
(5)由图分析可得:NH4VO3在分解过程中先分解失去NH3,再分解失去H2O;
本题难度:一般
4、选择题 工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是
[ ??? ]
①节省能源 ②不产生污染大气的SO2 ③提高H2SO4的利用率 ④提高了Cu的利用率
A.①②
B.①②③
C.②③④
D.全部
参考答案:B
本题解析:
本题难度:一般
5、填空题 (18分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)在离子交换膜法电解饱和食盐水过程中,与电源正极相联的电极上所发生反应为__________,与电源负极相连的电极附近溶液的pH__________(选填“不变”“升高”“降低”)。
(2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应的离子方程式为______________________________。
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________.冷却.__________(填写操作名称)除去NaCl。
(4)现有阳离子交换膜.阴离子交换膜.石墨电极和如下图所示电解槽,用氯碱工业中的离子交换膜技术原理,可通过电解电解饱和Na2SO4溶液的方法生产NaOH溶液和H2SO4溶液.则电极c为__________极(填“正”.“负”.“阴”.“阳”),b为__________离子交换膜(填“阴”.“阳”)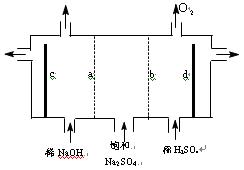
参考答案:(1)2Clˉ-2eˉ="=" Cl2↑(2分)?升高(2分
本题解析:略
本题难度:一般