微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数(???)
A.5.4×10—5
B.4.5×10—4
C.0.015
D.无法计算
参考答案:B
本题解析:
试题分析:在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;依据平衡三段式列式计算得到平衡浓度: Cl2+H2O?H++Cl-+HClO
起始浓度:0.09??? 0??? 0???? 0
转化浓度:0.03?? 0.03? 0.03? 0.03
平衡浓度:0.06?? 0.03? 0.03? 0.03
K=c(H+)c(Cl?)c(HClO) c(Cl2) ="0.03×0.03×0.03" 0.06 =4.5×10-4
本题难度:一般
2、选择题 在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN? 3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
A.加入少量氯化钾固体
B.加入少量氯化铁固体
C.减少Fe(SCN)3的浓度
D.加水稀释
参考答案:D
本题解 析:
试题分析:A、根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,平衡不动,故A错误;B、加入少量氯化铁固体,溶液中Fe3+浓度增大,平衡正向进行,溶液颜色加深,故B错误;C、减少Fe(SCN)3的浓度,平衡正向进行,故C错误;D、加水稀释,离子浓度降低,溶液颜色变浅,c3(SCN-)?c(Fe3+)降低更多,平衡左移,故D正确;
本题难度:简单
3、计算题 将6 mol A、3 mol B充入容积为1 L的密闭容器中,进行如 下反应:2A (g)+ B (g)
下反应:2A (g)+ B (g)  2C (g)。经60 s后反应达到平衡,此时容器内压强为起始时压强的0.8倍,试计算:
2C (g)。经60 s后反应达到平衡,此时容器内压强为起始时压强的0.8倍,试计算:
(1)用A表示的反应速率;
(2)B的转化率;
(3)平衡时C的物质的量浓度。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
4、选择题 在体积一定的密闭容器中进行如下反应:X2(g)+2Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是
2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是
[???? ]
A.b ≤ 0.1mol/L
B.达平衡时,X2的正反应速率与Y2的逆反应速率相等
C.a ≥ 0.05 mol/L
D.该平衡时气体物质的量浓度之和小于(a+ b+0.2)mol/L.
参考答案:D
本题解析:
本题难度:一般
5、选择题 可逆反应A+a B  ?C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
?C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
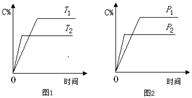
A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的?H增大
参考答案:D
本题解析:
试题分析:A、根据反应速率的大小确定温度和压强的大小,根据图1,T2时反应速率大,所以T2>T1,根据图2,p2反应速率大,所以p2>p1,正确;B、根据图1,温度升高,C的百分含量减小,平衡向左移动,所以该反应为放热反应,正确;C、压强变大,C的百分含量减小,平衡向左移动,逆反应方向气体系数减小,说明A为液态或固态,正确;D、?H与反应物的量无关,增加B的物质的量,该反应的?H不变,错误。
本题难度:一般