微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)下列关于氧化物的各项叙述正确的是__ (填写序号)。
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
(2)下列元素一定为主族元素的是____。
①最高正价为+6,并且不能与氢形成气态氢化物
②最外层电子数为1,并且有+1、+2两种化合价
③除最外层外,其余各电子层都达到了饱和
④次外层电子数是最外层电子数的3倍
⑤最外层电子数为3的一种元素
⑥能形成气态氢化物的一种元素
⑦最高价氧化物对应的水化物是酸的一种元素
(3)已建立化学平衡的某可逆反应,改变条件,使化学平衡向正反应方向移动时,下列叙述正确的是
____。
①生成物的物质的量分数一定增加
②生成物总产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤反应物的浓度一定增大
⑥正反应速率一定大于逆反应速率
⑦一定使用催化剂
(4)A、B、C是三种互不同族也不同周期的短周期元素,原子序数总和为26,它们可以形成一种三原子化合物,这种化合物的化学式是____。
2、选择题 对于可逆反应,当确知其平衡向正反应方向移动时,下列说法中正确的是[???? ]
A.生成物的产量一定增大
B.生成物的质量分数一定增大
C.生成物的浓度一定增大
D.反应物的转化率一定增大
3、选择题 在密闭容器中发生如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是[???? ]
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是[???? ]
A.m+n>p
B.平衡向正反应方向移动
C.A的转化率降低
D.C的体积分数增加
4、填空题 光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料等方面都有应用。以CO和Cl2为原料合成光气的反应为CO(g)+Cl2(g)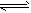 COCl2(g)。某小组同学将不同量的CO和Cl2分别通入体积为2L的恒容密闭容器中进行上述反应,得到如下数据:
COCl2(g)。某小组同学将不同量的CO和Cl2分别通入体积为2L的恒容密闭容器中进行上述反应,得到如下数据:
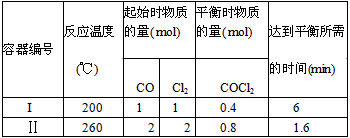
试回答下列问题:
(1)对容器I中的反应,能判断反应达到平衡状态的是_______(填字母)。
A.v正(CO)=v逆(COCl2)
B.三种物质的浓度之比为1:1:1
C.容器内气体密度保持不变
D.容器内压强保持不变
(2)容器Ⅱ中,从开始至达到平衡时,v(Cl2)=________。
(3)该反应的逆反应为____(填“吸热”或 “放热”)反应。
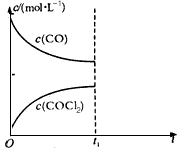
(4)其他条件不变,若在t1时刻,将容器Ⅱ的体积增大一倍,请在下图中画出重新达到平衡过程中c(CO)、c(COCl2)的变化曲线(只需画出浓度的变化趋势,无需标出平衡时的具体数值)。
(5)一定体积下,向某恒容密闭容器中充入3 mol CO和3 mol Cl2,发生上述反应,达到平衡后只改变某一条件,平衡体系发生如下变化,请在表中填写改变的条件。

5、选择题 在密闭容器中进行如下反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
①平衡不发生移动????②平衡沿着正反应方向移动???③平衡沿着逆反应方向移动???④NH3的质量分数增加????⑤正逆反应速率都增大.
A.①⑤
B.①②⑤
C.③⑤
D.②④⑤