微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程一定不能自发进行的是
A.2N2O5(g)=4NO2(g)+O2(g);ΔH>0
B.2CO(g)=2C(s)+O2(g);ΔH>0
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);ΔH>0
D.2H2(g)+O2(g)=2H2O(l);ΔH<0
参考答案:B
本题解析:
试题分析:A项ΔS>0,ΔH>0,则反应可能自发可能非自发,B项ΔS<0,ΔH>0,则反应一定不能自发,C项ΔS>0,ΔH>0,则反应可能自发可能非自发,D项ΔS<0,ΔH<0,则反应可能自发可能非自发。答案选B。
点评:ΔG=ΔH-TΔS。当ΔG<0一定自发,ΔG>0一定非自发。
本题难度:简单
2、选择题 下列反应一定不能自发进行的是( ? )
A.2SO3(g)?2SO2(g)+O2(g)△H>0
B.2C2H2(g)+5O2(g)?4CO2(g)+2H2O(g)△H<0
C.2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H>0
D.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0
参考答案:C
本题解析:
本题难度:一般
3、填空题 (15分,除标明外,其余每空2分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1时,实验测得20℃时的平衡转化率(α)是60%。20℃时上述反应的平衡常数K= 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”?“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”?“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1。下列能量关系图合理的是 (填字母)。

(4)该反应的ΔS (填“>”?“<”或“=”)0。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线
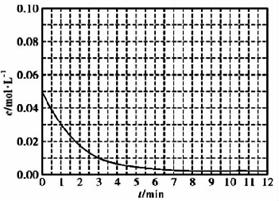
参考答案:(15分,除标明外,其余每空2分)
(1) 1.80m
本题解析:
试题分析:(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1 20℃时的平衡转化率(α)是60%时,平衡时(t-BuNO)2的浓度为0.50mol/L×(1-60%)=0.2mol/L,t-BuNO的平衡浓度是0.50mol/L×60%×2=0.6mol/L,所以该温度下的平衡常数K=0.62mol/L/0.2mol/L=1.8mol/L;
(2)当增大(t-BuNO)2的起始浓度,因为反应物为1种,则相当于增大压强,平衡逆向移动,则(t-BuNO)2的转化率减小;已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1<1.8mol/L,说明在四氯化碳中,反应逆向进行,则它在CCl4溶剂中的平衡转化率小于其在正庚烷溶剂中的平衡转化率;
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1,该反应是吸热反应,反应物的总能量低于生成物的总能量,排除B、C;活化能数值与反应热数值的比值小于2,A图不符合,所以答案选D;
(4)该反应中,物质的物质的量增加,混乱度增大,所以ΔS>0,因为ΔH>0,根据反应自发的判断依据ΔG=ΔH-TΔS<0反应自发,所以只有在较高温度时ΔG才可能小于0,反应自发;
(5)根据30℃时(t-BuNO)2浓度随时间变化的曲线,可计算出t-BuNO的浓度随时间的变化值,如:1min时(t-BuNO)2浓度减小0.05-0.03=0.02mol/L,则t-BuNO浓度从0增加到0.04mol/L,则(1,0.04)为一个点;3min时(t-BuNO)2浓度减小0.05-0.01=0.04mol/L,则t-BuNO浓度为0.08mol/L,(3,0.08)为1个点,依次做出不同时间的t-BuNO浓度的数值,用平滑曲线连起来即可,图像见答案。
考点:考查平衡常数的计算,化学反应与能量的关系图像的判断,反应自发依据的应用
本题难度:困难
4、选择题 250oC,101Kpa时,2N2O5(g)= 4NO2(g)+ O2(g) △H=+56.76kJ/mol,该反应能自发进行,其自发进行的主要原因是
A.是吸热反应
B.是放热反应
C.是熵减反应
D.熵增效应大于能量效应
参考答案:D
本题解析:
试题分析:反应能否自发进行取决于焓变和熵变的综合判据,在反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,可知该反应吸热,且熵值增大,根据△G=△H-T?△S判断,反应能自发进行,必须满足△H-T?△S<0才行,即熵增大效应大于能量效应,答案选D。
考点:考查反应热和焓变。
本题难度:一般
5、选择题 下列说法中正确的是
A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);ΔH<0,则该反应一定能自发进行
B.提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好
C.原电池放电过程中,负极质量一定减轻,正极的质量一定增加
D.由于Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2
参考答案:A
本题解析:
?
?试题分析:A.该反应是个体系混乱程度增大的放热反应。根据体系的自由能ΔG=ΔH-T·ΔS<0.所以反应一定能自发进行。正确。B. 提取海带中碘元素时,若用HNO3作氧化剂,会把反应产生的I2氧化为高价态的碘的化合物,而且还会产生大气污染物NO,因此用绿色氧化剂H2O2效果更好。错误。C. 原电池放电过程中,若为燃料电池,则负极和正极质量都不会发生变化。错误。D. 由于Ksp(MgCO3) > Ksp[Mg(OH)2],因此水
本题难度:一般