微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
①蒸发????????②蒸馏??????③过滤???????④萃取.
A.①
B.③④
C.④
D.②③
参考答案:①蒸发适用于从溶液中得到固体溶质,是从溶液中将溶质分离出来的
本题解析:
本题难度:一般
2、选择题 下列各组液体混合物,用分液漏斗不能分开的是[???? ]
A.苯和水
B.甘油和乙醇
C.乙醛和水
D.正己烷和水
参考答案:BC
本题解析:
本题难度:简单
3、实验题 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。

完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的???????(填序号)吸收。
a. 浓H2SO4??????? b. 浓HNO3??????c. NaOH溶液????? d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加????(填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是???(注明试剂、现象)。
?
?
实验室可用图的装置完成泡铜冶炼粗铜的反应。
(3)泡铜冶炼粗铜的化学方程式是????????????????????????????。
(4)装置中镁带的作用是????。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是??(填名称)。沙子能否换成水???(填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2+ + H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是???????。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
参考答案:(1)c? d (2分)?????
(2)硫氰化钾??
本题解析:
试题分析:(1)根据冰铜(mCu2O·nFeS)的组成元素可知,冰铜(mCu2O·nFeS)在空气中燃烧生成的气体A应该是SO2气体。SO2是大气污染物,属于酸性氧化物,因此可用来吸收SO2的试剂是氢氧化钠溶液或氨水。浓硫酸不能吸收SO2,浓硝酸吸收SO2又生成大气污染物NO2,所以正确的答案选cd。
(2)检验铁离子的试剂是KSCN溶液。由于亚铁离子检验还原性,所以检验溶液中还存在亚铁离子的操作是另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+。
(3)根据装置图可知,该反应是铝热反应,化学方程式是3Cu2O+2Al 6Cu+ Al2O3。 6Cu+ Al2O3。
(4)铝热反应需要高温,而镁燃烧可以放出大量的热量,所以镁带的作用是燃烧放出大量的热,创造高温环境(或引燃剂);由于在铝热反应中还需要助燃剂氯酸钾,所以泡铜和铝粉混合物表面覆盖少量白色固体a是氯酸钾。由于铝热反应会放出大量的热量,使生成的金属熔化,如果用水代替沙子,容积击穿坩埚,所以不能用社会代替沙子。
(5)消耗滴定剂的物质的量是0.001bcmol,则根据滴定反应Cu2+ + H2Y2–=CuY2–+ 2H+可知,20.00ml硫酸铜溶液中硫酸铜的物质的量是0.001bcmol,则100ml溶液中硫酸铜的物质的量是0.005bcmol,所以CuSO4·5H2O质量分数的表达式是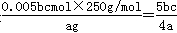 。 。
(6) a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中,属于正确的操作,结果不影响;b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定,溶液相当于被稀释,但硫酸铜的物质的量不变,因此结果不变;c.滴定前,滴定管尖端有气泡,滴定后气泡消失,这说明消耗滴定剂的体积增加,因此硫酸铜的物质的量增加,测定结果偏高,答案选c。2尾气处理;铁离子以及亚铁离子的检验;铝热反应;滴定反应计算和误差分析
本题难度:一般
4、选择题 下列说法中正确的是
A.1?L水中溶解了58.5?g?NaCl,该溶液的物质的量浓度为1?mol/L
B.从1?L?2?mol/L的H2SO4溶液中取出0.5?L,该溶液的浓度为1?mol/L
C.配制480?mL?0.5?mol/L的CuSO4溶液,需62.5?g胆矾
D.10?g?98%的硫酸(密度为1.84?g?cm-3)与10?mL18.4?mol?L-1的硫酸的浓度不同
参考答案:C
本题解析:分析:A来源:91考试网 91ExAm.org、溶液体积不是1L;
B、溶液是均一稳定的分散系;
C、配制480ml溶液,需要在500ml容量瓶中配制0.5 mol/L的CuSO4溶液,从中量取出480ml溶液;
D、依据溶质质量分数和物质的量浓度换算计算判断.
解答:A、1 L水中溶解了58.5 g NaCl物质的量为1mol,溶液体积大于1L,溶质的量浓度小于1 mol/L,故A错误;
B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,溶液是均一稳定的分散系,该溶液的浓度为2mol/L,故B错误;
C、配制480 mL 0.5 mol/L的CuSO4溶液,需要在500ml容量瓶中配制0.5 mol/L的CuSO4溶液,从中量取出480ml溶液;称取0.25molCuSO4?5H2O,质量为0.25mol×250g/mol=62.5g,故c正确;
D、10 g 98%的硫酸(密度为1.84 g?cm-3)物质的量浓度=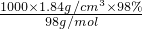 =18.4mol/L,和10 mL18.4 mol?L-1的硫酸的浓度相同,故D错误; =18.4mol/L,和10 mL18.4 mol?L-1的硫酸的浓度相同,故D错误;
故选C.
点评:本题考查了溶液浓度计算,溶液浓度 换算,配制溶液的方法和计算,题目难度中等.
本题难度:一般
5、简答题 自然界中的物质多数是以混合物的形式存在,对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等.下列各组混和物的分离或提纯应采用什么方法?
①提取碘水中的碘,用______方法.
②除去食盐溶液中的水,可采用______的方法.
③氧化铜中含有铜绿[主要成分为碱式碳酸铜Cu2(OH)2CO3]可用______的方法.
参考答案:①碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳
本题解析:
本题难度:一般
|