微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
压强/MPa
| 10
| 20
| 30
| 60
| 100
|
NH3含量(体积分数)/%
| 81.5
| 86.4
| 89.9
| 95.4
| 98.8
?
从表中数据可以推断:随着压强增大,平衡时NH3含量
A.增加
B.减少
C.先增加,后减少
D.先减少,后增加
参考答案:A
本题解析:增大压强。平衡向体积缩小的方向移动
本题难度:简单
2、选择题 在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)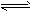 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 [???? ] 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 [???? ]
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol/L
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
参考答案:B
本题解析:
本题难度:一般
3、选择题 一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
参考答案:60%; 本题解析: 本题解析:
试题分析:(1)N2 (g)+3H2(g)  2NH3 (g) 2NH3 (g)
起始量(mol)?? 0?????? 0????????? 2a
转化量(mol)??? x????? 3x???????? 2x
平衡量(mol)??? x????? 3x??????? (2a-2x)
所以根据题意可知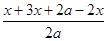 =1.4 =1.4
解得x=0.4a
若开始时充入a mol N2和3a mol H2的混合气体,达到平衡时,与开始充入2a mol NH3平衡等效
所以反应的H2的物质的量为:3a-3x=3a-3×0.4a=1.8a mol
所以H2的转化率为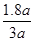 ×100% =60% ×100% =60%
(2)NH3在混合气体中的体积分数: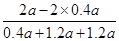 = =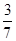 (或42.9%) (或42.9%)
本题难度:一般
4、选择题 2A(g) 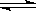 2B(g)+C(g);△H>0,达平衡时,要使V正降低、c(A)增大,应采取 2B(g)+C(g);△H>0,达平衡时,要使V正降低、c(A)增大,应采取
A.加压???????? B.减压???????????C.升温???????????? D.降温
参考答案:D
本题解析:
试题分析:增大压强或升高温度反应速率都是增大的,A、C不正确;正反应是体积增大的可逆反应,所以降低压强平衡向正反应方向移动,A的浓度降低,B不正确;由于正反应是吸热反应,所以降低温度反应速率降低,平衡向逆反应方向移动,c(A)增大,所以答案选D。
点评:外界条件条件对化学平衡状态的影响主要是依据勒夏特列原理进行判断。
本题难度:一般
5、填空题 氨基甲酸铵常用于生产医药试剂、发酵促进剂、电子元件等,是一种可贵的氨化剂。某学习小组研究在实验室中制备氨基甲酸铵的化学原理。?
(1)将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s) NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
|