微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )
A.+4、6
B.+7、7
C.+5、7
D.+5、5
参考答案:C
本题解析:根据方程式可知,Y的最低价是-1价,所以Y是第ⅦA元素,最外层电子数是7个。根据电荷守恒可知,n=1,所以YO3n-中Y元素的化合价是+5价,答案选C。
本题难度:一般
2、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A.1/5 mol
B.2/5 mol
C.3/5mol
D.11/5 mol
参考答案:A
本题解析:
【错解分析】错选B项。从化学方程式可以看出,15molCuSO4生成6molH3PO4,所以1mol CuSO4生成 2/5mol H3PO4错解原因没有注意到生成物中的H3PO4有一半是P自身氧化还原反应(歧化反应)生成的。
【正解】本专题复习一定要紧扣概念,理顺关系,正确分析元素化合价及其变化情况。重点解决(1)电子转移(2)氧化性、还原性及其强弱判断(3)相关计算的方法、技巧等方面的问题。本题中的还原剂是P,而氧化剂是P和CuSO4。由于反应过程中Cu从+2降为+1,因此反应中共得到15mol的电子;而做还原剂的P在反应中从0升至+5价,因此1mol P得到5mol电子。因此15molCuSO4在反应中氧化3mol的P,即每摩尔硫酸铜能够氧化0.2mol的P
本题难度:一般
3、填空题 在2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O反应中。
(1)????元素被氧化,氧化产物是?????????; 还原产物是?????????;氧化剂和还原剂的物质的量之比为????????
(2)用双线桥法表示该反应的电子转移情况。
参考答案:(1)Cl????Cl2??? MnCl2??? 5:1
本题解析:
试题分析:由元素化合价的升降可知,氯元素被氧化,氧化产物为Cl2,还原产物为MnCl2,氧化剂和还原剂的物质的量之比为5:1.
本题难度:一般
4、选择题 关于氧化还原反应CuO+H2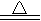 Cu+H2O,下列说法中正确的是
Cu+H2O,下列说法中正确的是
A.CuO是还原剂,H2是氧化剂
B.CuO是氧化剂,H2是还原剂
C.反应中Cu的化合价没有改变
D.反应中H的化合价没有改变
参考答案:B
本题解析:反中铜的化合价由+2价降至0价,得电子,被还原,氧化铜为氧化剂;氢元素化合价由0价升至+1价,失电子,被还原,氢气为还原剂。答案为B
本题难度:简单
5、选择题 下列化学用语使用正确的是(? )
A.葡萄糖、淀粉的最简式都是CH2O
B.CH4的电子式是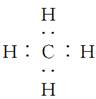
C.乙醛分子的结构简式是CH3COH
D.丙烷分子的球棍模型是
参考答案:B
本题解析:A项,淀粉的最简式为C6H10O5;C项,乙醛的结构简式为CH3CHO;D项,所给球棍模型可表示丙烯。
本题难度:一般