微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是(???)
A.浓H2SO4
B.稀H2SO4
C.浓HNO3
D.稀HNO3
参考答案:C
本题解析:根据化学方程式,可知浓HNO3与Cu反应生成NO2的物质的量最大。
本题难度:简单
2、选择题 含n g硝酸的稀溶液恰好和m g铁粉完全反应若有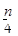 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能
A.1:1
B.2:1
C.3:1
D.9:2
参考答案:CD
本题解析:此题可以用极限法求解。假设一,铁粉刚好完全消耗干净,只能还原n/4g硝酸,那就有方程表达:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,理清关系有:Fe~NO,可看出被氧化的铁粉与被还原的硝酸(根据元素守恒)具有相同的物质的量,于是有计算式m/56=n÷4÷63由此推出n:m=9:2
假设二,铁粉过量,硝酸被完全消耗,甚至连三价铁离子也被铁单质全部还原成亚铁离子。在这种情况下,根据氧化还原反应电子得失守恒,mg铁粉提供电子总物质的量为m÷56×2=m/28mol,而硝酸得到的电子为,n÷4÷
本题难度:一般
3、实验题 某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)
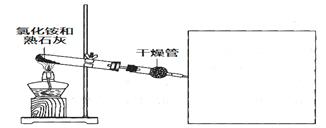
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸??? b. 碱石灰??? c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________
参考答案:(8分)(1)2NH4Cl+Ca(OH)2
本题解析:
试题分析:(1)实验室用熟石灰和氯化铵加热制备氨气,则制备氨气的化学方程式是2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)氨气是碱性气体,极易溶于水,不能用浓硫酸和氢氧化钠溶液干燥,选择的干燥剂是碱石灰,答案选b。
(3)氨气极易溶于水,不能用排水法收集。又因为氨气的
本题难度:一般
4、实验题 (15分)陇东中学高三2、4班学生设计了以下 实验方案验证Ag与浓HNO3反应的
实验方案验证Ag与浓HNO3反应的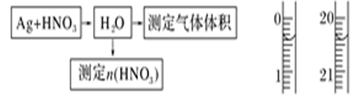
⑴测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶 液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置
液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置 如上图所示。在B容器中生成硝酸的物质的量为__
如上图所示。在B容器中生成硝酸的物质的量为__ __________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
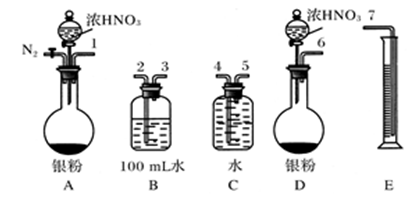
⑵测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是____________________________________________________________
__________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是________________________________。
参考答案:(18分)
⑴0.008 mol??(2分)????
本题解析:略
本题难度:一般
5、选择题 铁或铝能在冷的浓硝酸中发生“钝化”,这是利用浓硝酸的( )?
A.强酸性
B.强氧化性?
C.不稳定性
D.挥发性?
参考答案:B?
本题解析:“钝化”是利用浓硝酸的强氧化性,把金属表面氧化成致密的氧化物保护膜。
本题难度:简单