微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对化学反应限度的叙述,不正确的是( )
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.达到化学平衡状态也就达到化学反应的最大限度
D.化学反应的限度是不可改变的
参考答案:A.可逆反应不可能完全转化,当正逆反应速率相等时,达到反应限
本题解析:
本题难度:简单
2、选择题 已知反应3A(g)+B(g)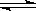 C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度?②升高反应温度?③缩小反应容器的体积(加压)?④加入催化剂(???? )
C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度?②升高反应温度?③缩小反应容器的体积(加压)?④加入催化剂(???? )

A.①②
B.①③
C.②③
D.③④
参考答案:D
本题解析:
试题分析:根据图像可知,使反应过程按b曲线进行,和a曲线比较,反应的平衡状态没有变化,但反应速率加快,达到平衡的时间减少。由于该反应是反应前后体积不变的可逆反应,因此改变的条件只可能是使用了催化剂或增大压强,答案选D。
点评:外界条件对平衡状态的影响一般是温度、浓度、压强等,在具体判断时一般遵循勒夏特列原理进行分析
本题难度:一般
3、选择题 工业上制备纯硅的热化学反应方程式为:SiCl4(g) + 2H2(g) Si(s) + 4HCl(g);△H =" +" Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是(???)
Si(s) + 4HCl(g);△H =" +" Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是(???)
A.反应过程中,若增大压强能提高硅的产率
B.若反应开始时H2为2 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl的浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中能恰好完全反应
参考答案:D
本题解析:A项,增大压强,平衡逆向移动,硅的产率降低,A不正确。H2为2 mol,如果完全反应,则吸收热量为Q kJ,该反应是一个可逆反应,所以应小于Q kJ,B不正确。
C项,HCl的反应速率为0.03 mol/(L·min),根据速率比等于化学系数比,知H2的反应速率为0.15 mol/(L·min),所以C项不正确。当反应吸收热量为0.025Q kJ时,说明有0.1mold的HCl生成,所以D正确。
本题难度:简单
4、选择题 已知:CO2(g) + 3H2(g) 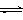 ?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.10min后,升高温度能使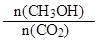 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1?min-1
参考答案:B
本题解析:
试题分析:A、该反应为放热反应,升高温度使平衡向左移动,所以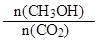 减小,错误;B、CO2的转化浓度为1.00mol?L?1-0.25mol?L?1=0.75mol?L?1,所以转化率为0.75mol?L?1÷1.00mol/L×100%=75%,正确;C、3 min时,反应还未达到平衡,所以用CO2的浓度表示
减小,错误;B、CO2的转化浓度为1.00mol?L?1-0.25mol?L?1=0.75mol?L?1,所以转化率为0.75mol?L?1÷1.00mol/L×100%=75%,正确;C、3 min时,反应还未达到平衡,所以用CO2的浓度表示
本题难度:一般
5、填空题 氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g)?ΔH=-92.4 kJ·mol-1
2NH3(g)?ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。

(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。

参考答案:(1)AD
(2)用湿润的红色石蕊试纸放在管口处,若试
本题解析:(1)勒夏特列原理只解释平衡移动问题。(2)根据氨的性质进行检验。(3)合成氨的反应是可逆反应。(4)根据合成氨反应中的氧化剂、电解池中阴极反应特点及电解质成分进行分析。
本题难度:一般