微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲醇燃料电池可用于笔记本电脑等,它一极通入氧气,另一极通入甲醇;电解质能传导H+。电池工作时,??? 2CH3OH+3O2 = 2CO2+4H2O ,下列说法正确的是
A.通甲醇一极为正极。
B.正极电极反应式 3O2 + 12H+ + 12e- = 6H2O
C.电池工作时电子从氧气一极流向甲醇一极。
D.当转移24mol e-时,消耗的甲醇2mol。
参考答案:B
本题解析:关于燃料电池的工作原理:通入燃料的一极为负极,即电子流出的一极,发生氧化反应的一极,阴离子移向的一极;通入空气(或氧化)的一极为正极,即电子流入的一极,发生还原反应的一极;所以
A错,通甲醇的一极为负极;B正确,正极为氧气得电子,在酸性电解质中其电极反应式为:3O2 + 12H+? + 12e- =? 6H2O;C错,电子的流向为由负级经导线流向正极;D错,根据氧化还原反应中,得失电子数相等的原则,可得当转移24mol e-时,消耗的甲醇4mol。
本题难度:一般
2、选择题 如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)下列有关说法正确的是
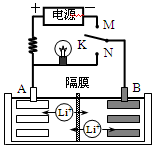
A.该电池的反应式为:
B.K与M相接时,A是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充电或放电过程中都只存在一种形式的能量转化
参考答案:B
本题解析:
试题分析:由题意放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2),故A项电池反应充、放电反了,故A项错误;K与M相接时,B电极接电源负极作阴极,A电极接电源正极做阳极,故B项正确;则该电池做电源时,A为正极,B为负极,K与N相接时,Li+由B极区迁移到A极区,故C项错误;由图象可知充电过程中为电能转化为化学能,放电过程中为化学能转化为电能和光能,故D项错误;本题选B。
考点:电化学原理。
本题难度:困难
3、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是[???? ]
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
参考答案:C
本题解析:
本题难度:一般
4、填空题 (14分)用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H= -1365.0KJ/mol
H2(g) +1/2 O2 (g) ="==" H2O(g) △H=" -241.8" KJ/mol
CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)的反应热△H= 。
CH3OH(g) + H2O(g)的反应热△H= 。
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol和1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。

①曲线c对应的投料是 。
②T1℃时,曲线a对应的化学平衡常数是 。
③500℃时 ,反应A的平衡常数K=2.5,T1℃ 500℃(填“高于” 、“低于” 或“等于” )。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下:
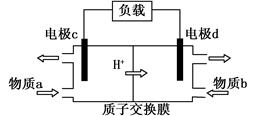
①d电极上发生的是 (填“氧化”或“还原”)反应。
②物质b是 (填化学式)。
③写出c电极的电极反应式 。
参考答案:(1)△H = -42.9kJ/mol(2分)
(2)
本题解析:
试题分析:(1)已知:①2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H=" -1365.0KJ/mol" ②H2(g) +1/2 O2 (g)===H2O(g)△H="-241.8" KJ/mol,根据盖斯定律:②×3—①×1/2得CO2(g)+3H2(g) CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g)
CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g) CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
考点:考查反应热的计算、盖斯定律,化学平衡和燃料电池。
本题难度:困难
5、简答题 最近我国自主研制了一种新型燃料电池,一个电极通入空气,另一个电极通入汽油蒸气?(以C4H10代表汽油),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.回答如下问题:
(1)C4H10有正丁烷、异丁烷两种结构,写出异丁烷的一氯取代物的结构简式______、______、______.
(2)这个燃料电池放电时发生反应的化学方程式是______.
(3)这个电池的正极发生的反应是O2+4e-=2O2-,负极发生的电极反应方程式是______,
(4)固体电解质里O2-向______极移动,向外电路释放电子的是______极.
参考答案:(1)异丁烷中氢原子的种类有三种,所以其一氯代物有三种,即C
本题解析:
本题难度:一般