微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在常温下,0.5mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量363.3kJ.写出该反应的热化学方程式: _________________________
(2)请设计一个燃料电池:电解质为强碱溶液,Pt作电极,在电极上分别通入甲醇和氧气。通入甲醇的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
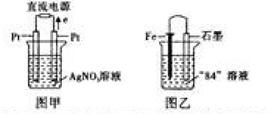
(3)用Pt电极电解盛有1L pH=6的硝酸银溶液,如图甲所示,则右边电极上发生的电极反应式为 .
(4)某化学学习兴趣小组为了研究金属的腐蚀现象,将一枚铁钉放在“84”消毒液(NaClO)中,某同学设计了如图乙所示实验装置,写出石墨极上发生的电极反应式:
参考答案:(1)CH3OH(l)+3/2O2(g)==CO2(g)+2
本题解析:
试题分析:(1)在热化学方程式中物质的计量系数表示的是物质的量,故0.5mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量363.3kJ则1mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量726.6KJ,其热化学方程式为:
CH3OH(l)+3/2O2(g)==CO2(g)+2H2O(l);△H=-726.6KJ·mol-1; (2)、燃料为负极,在强碱性溶液中甲醇的氧化产物应为碳酸盐,故电极上发生的电极反应为: CH3OH+8OH--6e-==CO32-+6H2O;(3)用惰性电极电解硝酸银溶液时阳极是氢氧根离子失电子产生氧气,也可以写成水失去电子产生氧气,剩余H+;(4)此装装置构成了原电池,ClO-具有氧化性,正极上得电子生成Cl-。
考点:热化学方程式的书写,原电池原理的应用
本题难度:一般
2、选择题 铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4
B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑
C.电解后,c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成2molH2O,电解池中就消耗1molH2O
参考答案:A
本题解析:放电相当于原电池,分解是铅失去电子,生成硫酸铅。正极是二氧化铅,得到电子,也生成硫酸铅,所以蓄电池放电时,每消耗0.1molPb,共生成0.2molPbSO4。选项A不正确,电解池中阳极失去电子,B正确。电解硫酸钠的本质是电解水,有硫酸钠晶体析出,但浓度不变,C正确。蓄电池中每生成2molH2O,就转移2mol电子,则生成1mol水,D正确。答案选A。
本题难度:一般
3、填空题 (共8分)新型高能钠?硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS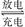 Na2Sx。
Na2Sx。
(1)放电时Na发生________反应(填:氧化或还原),S作________极
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为_______________________;
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
参考答案:(1)氧化 正 (2)负 (3)Na-e-=Na+ (4)6
本题解析:(1)放电相当于原电池,充电相当于电解池。原电池正负极失去电子,发生氧化反应,所以根据反应式可知钠是负极,发生氧化反应,硫是正极,发生还原反应。
(2)放电时正极发生还原反应,所以充电时就要发生氧化反应,因此充电时正极和电源的正极相连,负极和电源的负极相连。所以钠和电源的负极相连。
(3)负极失去电子,反应式为Na-e-=Na+。
(4)电解饱和NaCl溶液时,阳极氯离子放电,生成氯气,所以转移的电子是
 本题难度:一般
本题难度:一般
4、选择题 镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2= Mg2++2H2O。关于该电池说法正确的是
A.镁合金为电源负极,发生氧化反应
B.放电时H+在正极反应得电子
C.正极方程式为:H2O2+2e-=2OH-
D.放电时正极的pH降低
参考答案:A
本题解析:(—)Mg—2e—= Mg2+;(+)H2O2+2e—+2H+=2H2O,得到电子的是H2O2,判断B错有点难。
本题难度:一般
5、选择题 下列关于化学电源的说法不正确的是:
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电;
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源;
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了。
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极。
参考答案:B
本题解析:
试题分析:铅蓄电池放电时,消耗硫酸,使硫酸的密度减小,故A项正确;燃料电池是将化学能直接转化为电能,故B错误;普通锌锰干电池不能充电,故C正确;由Ag2O和Zn形成的碱性银锌纽扣电池,Zn发生氧化反应,故Zn作为负极,故D正确。
考点:本题考查原电池原理。
本题难度:一般