微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol?L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
参考答案:C
本题解析:由溶液 pH计算表达式可得,c(H+)=10-pHmol/L,则pH=4的醋酸中c(H+)=10-4 mol?L-1,A项错误;小苏打的化学式是NaHCO3,属于钠盐、酸式盐,在水中能完全电离,即NaHCO3="=" Na++HCO3-,钠离子不能水解,而HCO3-不仅少部分水解生成碳酸,还有少部分HCO3-电离出碳酸根离子,即HCO3-+H2O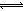 H2CO3+OH-、HCO3-
H2CO3+OH-、HCO3-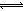 H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O
H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O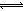 H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
【学科网考点定位】本题考查考生对溶液pH的了解;考查考生对盐类水解、弱电解质在水中的电离的了解;考查考生对水溶液中离子浓度大小的比较;考查考生对水的电离平衡和离子积常数的了解;考查考生对温度与平衡常数大小关系的了解。
本学科网解析为学科网名师学科网解析团队原创,授权学科网独家使用,如有盗用,依法追责!
二、双项选择题:本大题共2小题,每小题6分,共12分。在每小题给出四个选项中,有两个选项符合题目要求,全部选对的得6分,只选1个且正确的得3分,有选错或不答的得0分。
本题难度:一般
2、填空题 (11分)
(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填“甲”或“乙”);
(2) 烧杯中的酸过量(填“甲”或“乙”);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填“大”或“小”)。
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是 。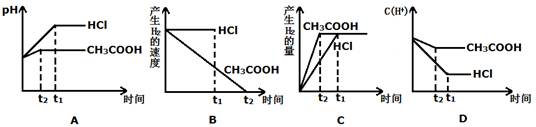
参考答案:(11分)
(Ⅰ)(1)甲 &#
本题解析:
试题解析:(I)(1)盐酸为强酸,醋酸为弱酸。体积和pH相等,可得n(HCl)<n(CH3COOH)。由于金属跟盐酸、醋酸的反应都是按1:2的比例进行反应的。因此与盐酸反应的锌应过量。
(2)得到相同质量的氢气,则反应掉的酸的物质的量相等,因此乙中的醋酸应剩余。
(3)反应后甲烧杯中的溶质为ZnCl2,乙烧杯中的溶质为(CH3COO)2Zn和CH3COOH;乙烧杯中的溶液为酸性,因此应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大。
(Ⅱ)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应。⑴若锌完全反应,则产生的H2相等;若醋酸完全反应,则产生的H2不相等。因此①②错误。⑵由于加入的锌的质量相等,而溶液中n(HCl)<n(CH3COOH),因此若有一份溶液中的锌有剩余,则应是盐酸中的锌有剩余,故③正确。⑶等倍稀释后,由于稀释促进了醋酸的水解,醋酸中c(H+)增大,因此反应速率增大,故④错误。⑷由于随着反应的进行,盐酸中c(H+)不断减小,而对于醋酸溶液中,c(H+)几乎保持不变,因此产生等量的H2所需的时间A>B,故⑤正确。⑸若产生等量的H2,可以是两种酸都有剩余,也可以是醋酸有剩余,故⑥错误。综上,说法正确的有③⑤。
(Ⅲ) 向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,反应后溶液的溶质分别为“ZnCl2和ZnCl2、CH3COOH”,因此A正确。对于选项B、对于产生H2的速率,应是与盐酸反应的会越来越慢;与醋酸反应的,其反应速率基本保持不变,故B错误。选项C、锌的质量相等,其完全反应,因此产生H2的质量想的,再结合对选项B的分析,可知,C图像表示的正确。选项D、随着反应的进行,盐酸中c(H+)不断减小,但醋酸会不断电离出H+,因此其浓度减小的较慢,因此选项D说法正确。综上,答案选ACD。
考点:电解质溶液;弱酸的电离
点评:本题考查电解质溶液的相关知识,是高考的常见考题,掌握弱酸的电离是解题的关键。对于此类题型,应加强训练总结,以求达到举一反三的效果。
本题难度:一般
3、实验题 某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃)
| 10
| 20
| 30
| 50
| 70
| 80
| 100
|
pH
| 8.3
| 8.4
| 8.5
| 8.9
| 9.4
| 9.6
| 10.1
?
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
参考答案:(本题共12分,每空1分)
(1) 本题解析: 本题解析:
试题分析:(1)NaHCO3为弱酸酸式盐,可发生电离,也发生水解反应,根据实验1表中数据可知NaHCO3溶液呈碱性,所以以水解为主。
(2)加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊,说明生成的气体为CO2。
(3)实验2温度升高,溶液的pH增大,说明加热促进了NaHCO3的水解,实验三生成了CO2,可能为NaHCO3发生了分解反应。
(4)Na2CO3溶液的pH大,说明Na2CO3溶液的碱性强,水解程度大。
(5)加水至200mL,与原溶
本题难度:困难
4、选择题 在0.1 mol/L的NH3·H2O溶液中,下列关系正确的是(???)
A.c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)
D.c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
参考答案:A
本题解析:
【错解分析】电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握及对这些知识的综合运用能力。
【正解】NH3·H2O是一元弱酸,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O 本题难度:一般 本题难度:一般
5、选择题 体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,分别用同物质的量浓度的NaOH溶液完全中和时,所消耗的NaOH溶液的体积关系正确的是
A.②=①>③
B.②>①>③
C.②<①=③
D.③>②=①
参考答案:D
本题解析:
试题分析:体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,因为稀醋酸是弱酸,部分电离,故醋酸的物质的量浓度最大,故等体积消耗的NaOH溶液的体积最多;pH相同的 ①稀盐酸 ②稀硫酸,两者均为强电解质,c(H+)相同,故消耗NaOH溶液的体积相同,故D项正确。
考点:弱电解质电离。
本题难度:一般
|