微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
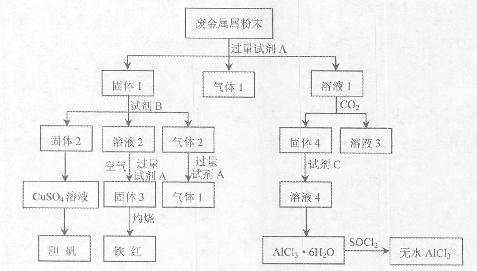
1、填空题 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
已知:?①Al3+、Al(OH)3、AlO2-有如下转化关系:
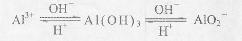
②碳酸不能溶解Al(OH)3。
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是???????????????。
(2)溶液2中含有的金属阳离子是???????;气体2的成分是????????。
(3)溶液2转化为固体3的反应的离子方程式是??????????。
(4)固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4,并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是??????????????????。?
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是????????????????。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是????????????。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是????????????????????。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、选择题 (2009陕西西安八校联考,11)现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除 、Cl-外,还含有的金属阳离子是(???)
、Cl-外,还含有的金属阳离子是(???)
A.Zn2+、Cu2+、Fe3+
B.Zn2+、Fe2+、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+
D.Zn2+、Fe3+
参考答案:C
本题解析:本题考查反应的先后顺序问题。利用金属活动顺序表解决问题。假设CuSO4、FeCl3、Zn的物质的量各为1 mol。
2Fe3++ Zn====2Fe2++Zn2+
1 mol?? 0.5 mol
Cu2++ Zn====Cu+Zn2+
0.5 mol? 0.5 mol
所以溶液中含有的金属离子为Zn2+、Cu2+、Fe2+。
本题难度:一般
3、选择题 向盛有a g镁铝合金的烧杯中加入cl mol/L稀硫酸V1L,合金完全溶解后,再加入c2mol/L的NaOH溶液V2L,生成沉淀的质量恰好达到最大值bg。则下列关系式不正确的是(??)
A.2c1V1=c2V2
B.反应产生氢气的质量m(H2)= 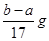
C.b≤a+17c2V2
D.合金中含镁的质量分数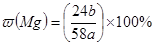
参考答案:D
本题解析:
分析:A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),2c1V1=c2V2,
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,n(H2)= 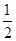
本题难度:一般
4、计算题 钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到 气体
气体
224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的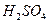 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:
???实验序号
| ??? I
| ???Ⅱ
| ???Ⅲ
|
???加入钢样粉末的质量/g
| ??? 2.812
| ??? 5.624
| ??? 8.436
|
?生成气体的体积/L(标准状况)
| ??? 1.120
| ??? 2.240
| ??? 2.800
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
参考答案:(1)解:6.62g铁矿石中铁的质量为
![]()
本题解析:(1)解:6.62g铁矿石中铁的质量为
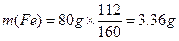
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石) < <
本题难度:一般
5、选择题 向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A.1.14g
B.1.6g
C.2.82g
D.4.36g
参考答案:B
本题解析:略
本题难度:一般
|