微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氟化铜是一种锂/氟化铜电池正极活性材料,可通过下列方法制备:在铂皿中将氧化铜用过量的40%氢氟酸溶解,先制成CuF2·5HF·5H2O,再将生成物放入镍管内的铂舟中,在干燥的氟化氢气流中以400%进行加热脱水,最后通入氮气。
(1)制备过程中用铂皿而不用玻璃器皿的原因是______________________________________(用化学方程式表示)。
(2) 锂/氟化铜电池放电时总反应为置换反应,其化学方程式为____________________________________________________。
(3)准备称取上述制备的样品(仅含CuF2和CuO) 2.120 g,在通风橱中加入稀硫酸至完全溶解,然后加入足量的氢氧化钠溶液,得沉淀,将沉淀充分灼烧,得1.680 g黑色固体,计算样品中CuF2和CuO的物质的量之比。
参考答案:(1)SiO2+4HF=SiF4↑+2H2O
(2)C
本题解析:(1)氢氟酸会腐蚀玻璃,生成SiF4。(2)题给信息中已经标明了反应物是锂和氟化铜,且注明了反应类型。(3)由题意知:CuF2、CuO→CuSO4→Cu(OH)2→CuO,故可用差量法求出CuF2。
CuF2 ~ CuO Δm
102 g ?????????80 g??22 g
m(CuF2) 2.120 g-1.680 g=0.440 g
m(CuF2)= 本题难度:一般
本题难度:一般
2、选择题 将铜片投入到稀硫酸中,铜片不溶,再加入下列试剂后,可使铜片溶解的是(???? )
A.稀盐酸
B.硫酸钠晶体
C.硝酸钠晶体
D.氯化铁晶体
参考答案:CD
本题解析:稀盐酸不能溶解铜,硫酸钠也不能溶解铜。在酸性溶液中,硝酸盐具有强氧化性,能把铜氧化,而硝酸则被还原生成NO,C正确。氯化铁中的铁离子能把铜氧化生成铜离子和亚铁离子,D正确。所以答案选CD。
本题难度:一般
3、实验题 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
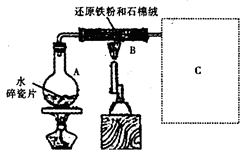
(1)装置B中发生反应的化学方程式是????????????????????????????????????。
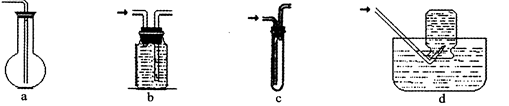
(2)虚线框图C的气体收集装置是下图中的???????????(选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:?
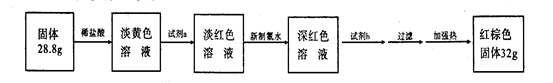
试剂a的化学式是????????????,试剂b的化学式是????????????;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)??????????????????????????????????。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
??????????????????????????????????????????????????????????????????;为了对所提出的假设2进行验证,实验方案是???????????????????????????????????????
???????????????????????????????????????????????????????????????????????。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为??????????????。
参考答案:
(1)3Fe + 4H2O  本题解析:
本题解析:
试题分析:(2)氢气难溶于水,可用排水法收集。选bd。
(3)因为铁和水反应生成Fe3O4,Fe3O4,+8HCl=2FeCl3+FeCl2+4 H2O 。淡黄色溶液含少量Fe3+,加a:KSCN,Fe3++3SCN- =Fe(SCN)3 ?少量淡红色。加新制的氯水,把FeCl2氧化变成FeCl3和KSCN生成
Fe(SCN)3,再加NaOH,能生成Fe(OH)3 ?。加热Fe(OH)3变成红棕色的Fe2O3
(4)“SCN-被过量的氯水氧化”,为证明此假设,需加过量的KSCN溶
本题难度:困难
4、填空题 上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
A.稀硫酸
B.氨水
C.氢氧化钠溶液
D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________________________________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
参考答案:(1)Fe2+、Fe3+ (2)B
(3)取少量溶液,
本题解析:(1)硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)酸浸后过滤,SiO2为滤渣,滤液中含有的金属阳离子是Fe2+、Fe3+。(2)步骤Ⅲ要把pH调高,步骤Ⅳ还要加NH4HCO3,故使用氨水。若使用氢氧化钠溶液,产品中容易混入Na+,所以选B。(4)NH4HCO3受热易分解,高温会促进Fe2+水解。
本题难度:一般
5、填空题 已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁。电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是??????????,证明Fe3+存在的现象是?????????????。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式(1分):????????????????????
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
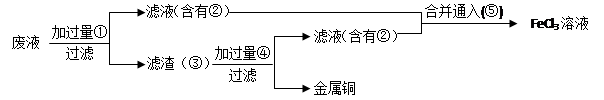
A.请写出上述实验中加入或生成的有关物质的化学式:
①?????????????,②???????????,④????????????,
B.请写出含有②的滤液与⑤反应的离子方程式(1分):??????????????????????????????????
该反应中氧化剂为???????????还原剂为???????????。
参考答案:(9分)(1)KSCN;溶液呈红色 ;(2) 2Fe3++C
本题解析:
试题分析:(1)铁离子能和KSCN溶液发生显色反应,溶液显红色,所以检验溶液中Fe3+存在的试剂是能和KSCN溶液。
(2)氯化铁能和氧化金属铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)要从废液中回收金属铜,则需要加入还原剂铁粉,即①是Fe。过滤后生成的滤液是氯化亚铁,即②是氯化亚铁。而滤渣中含有铜和剩余的铁,则需要加入稀盐酸溶解铁,即④是HCl。滤液中含有氯化亚铁,要转化为氯化铁,则需要通入氯气将氯化亚铁氧化生成氯化铁即可。
点评:该题是高考中的常见题
本题难度:一般