微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有? ________________________________;?
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);?
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1 H2SO4溶液/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
?
①请完成此实验设计,其中:V1= ,V6= ,V9= ;?
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;?
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。?
2、选择题 关于反应速率的说法中,正确的是( )
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的因素是反应温度
C.可逆反应达到化学平衡时,正逆反应速率都为0
D.增大反应物浓度,升高温度都能增大反应速率
3、填空题 (14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是????????????????????????????????????????????;
(2)要加快上述实验中气体产生的速率,还可采取的措施有????????????????(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
???????????实验
混合溶液
| A
| B
| C
| D
| E
| F
| 4 mol·L-1H2SO4?/ mL
| 30
| V1
| V2
| V3
| V4
| V5
| ?饱和CuSO4溶液 / mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
| H2O / mL
| V7
| V8
| V9
| 15
| 10
| 0
??????请完成此实验设计,其中:V2 ?????V5 =???????????, V6=??????????,V8=???????????;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的p 91exam .orgH如下表:
组别
| c(HA)/mo1·L-1
| c(NaOH)/mo1·L-1
| 混合液pH
| 甲
| c
| 0.2
| pH = 7
| 乙
| 0.2
| 0.1
| pH>7
| 丙
| 0.1
| 0.1
| pH = 9
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ??????(选填“是”或“否”)。
(5)分析乙组实验数据,HA是?????酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是???????????????????????????????????。
(6)丙组所得混合液中由水电离出的c(OH-) =??????????mo1·L-1。
4、选择题 下列描述违背化学原理的是( )
A.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
B.可逆反应A(g)+3B(g)?2C(g)达平衡后,增大压强,正速率增大,逆速率减小
C.SO2的催化氧化生成SO3,是一个放热的反应,升高温度,反应速率加快
D.电解熔融NaCl时,阴极的电极反应式为:Na++e-=Na
5、选择题 在500℃和催化剂存在的条件下,在固定容积的容器中发生如下反应2SO2(g)+O2(g)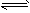 2SO3(g)(正反应放热)。下列有关说法正确的是[???? ] 2SO3(g)(正反应放热)。下列有关说法正确的是[???? ]
A.若降低温度,可以加快反应速率
B.在上述条件下,SO2能完全转化为SO3
C.使用催化剂是为了加快反应速率
D.达到平衡时,SO2和SO3的浓度一定相等
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772