α3
A.Q3+92.4c1=92.4???????? B.α2+α3<1 ?
C.2p1=2p3<p2????????????D.达到平衡时丙容器中NH3的体积分数最大
参考答案:A
本题解析:
试题分析:恒温恒容时,甲和丙为等效平衡。所以:α1+α3=1、Q1+Q3=92.4、Q1=92.4c1(当生成2mol氨气时,放热92.4kJ,此时氨气的浓度为1mol/L)。故A正确;乙中投料是甲的2倍,相当于在甲的基础上增大压强,平衡向右移动,氮气的转化率增大、氨气的体积分数增大、气体的压强减小,所以α2+α3>1 、 2p1=2p3>p2,故B、C、D错误。
本题难度:一般
2、选择题 在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是( )
A.A(g)+B(g) C(g) C(g)
B.A(g)+2B(g) 3C(g) 3C(g)
C.A(g)+B(g) C(g)+D(g) C(g)+D(g)
D.以上都达到平衡
参考答案:A
本题解析:A中反应前后气体物质的量不等,恒温恒容下总压强不变,反应达平衡;B、C反应前后气体物质的量相等,不论是否达到平衡总压强不变。
本题难度:一般
3、填空题 1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)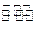 Na2S(s)+4H2O(g)。 Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为?????????。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变???????????????????????????????????? b.容器内气体密度保持不变
c.c(H2)=c(H2O)??? d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:????????②加入少量灼热的碳粉,则平衡:__???
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___??_,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是????????。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、计算题 在一密闭的2L容器里装有2molN2和6molH2 ,在一定条件下开始反应, 2min末测得容器中有1.2mol H2 ,请计算2min末NH3的浓度。
参考答案:2min末NH3的浓度 1.6 mol/L
本题解析:
试题分析:发生反应的化学方程式为:
N2?? +?? 3H2?? =?? 2NH3
开始的物质的量?? 2mol???? 6mol????? 0
反应的物质的量?? 1.6mol?? 4.8mol??? 3.2mol
2min末物质的量?? 0.4mol??1.2mol??? 3.2mol
c="n/V=3.2mol/2L=1.6" mol/L。
点评:本题考查的是化学反应速率的相关计算,题目难度中,考查学生对基础知识的掌握程度及计算的能力。
本题难度:一般
5、计算题 (本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
t
c???
| 初始
| 2min
| 4min
| 6min
| 8min
| c(A)( mol·L -1)
| 2.50
| 2.20
| 2.00
| 2.00
| 2.20
| c(B)( mol·L -1)
| 1.56
| 2.16
| 2.56
| 2.56
| 2.16
| c(C)( mol·L -1)
| 0.39
| 0.54
| 0.64
| 0.64
| 1.54
请填空:
(1)前2mim内,v(B)= ?????????????????。
(2) 到2mim末A 的转化率为???????????。
(3)该反应的化学方程式为?????????????????????。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为??????(填选项字母)
a.增大A的浓度??? b.减小B的浓度?? c.增大C的浓度
则该物质的浓度改变量为???????????????mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则?????是原来的2倍。
a. A的转化率??????b. B的平衡浓度?表? c.达到平衡的时间?????? d.平衡时气体的密度
参考答案:(本题共12分,每空2分)(1)?? 0.30mol/L.m
本题解析:(1)根据表中数据可知,前2min内B的浓度增加了2.16mol.L-1.56mol/L=0.6mol/L,所以反应速率是0.6mol/L÷2min=0.3mol/(L·min)。
(2)2min末时A的浓度降低了0.30mol/L,所以A的转化率是0.30÷2.50×100%=12%。
(3)C的浓度增加了0.15mol/L,所以根据变化量之比是相应的化学计量数之比可知,反应的方程式是2A 4B+C。 4B+C。
(4)6 min~8 min时,A、C的浓度增加,B的浓度降低,所以改变的条件是增大了C的浓度,答案选c。
(5)温度不变,平衡常数不变;若开始加入的三种物质的物质的量浓度是原来的2倍,则相当于增大压强,平衡向逆反应方向进行,所以bc不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密度是原来的2倍。
本题难度:一般
|
|