微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
A.氮肥厂用氮气和氢气合成氨气
B.硝酸厂用氨氧化法制硝酸
C.从海水中提溴
D.纯碱厂用NaCl、NH3、CO2等制纯碱
参考答案:D
本题解析:
试题分析:A.N2+3H2 2NH3,反应前后元素的化合价发生了变化,是氧化还原反应。错误。B.4NH3+5O2
2NH3,反应前后元素的化合价发生了变化,是氧化还原反应。错误。B.4NH3+5O2 本题难度:一般
本题难度:一般
2、简答题 在500mL?某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).
(1)混合气体中NO2和NO体积比为______;
(2)所用HNO3的物质的量浓度为______mol/L;
(3)如图,若将上述反应产生的混合气体加入n?mol氧气一起通入水中,配成100mL溶液,所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系.
①a?点的数值是______mol;
②当n=0.12mol时,所得硝酸溶液的物质的量浓度______;
③通过计算,求出所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系式______,______.(写出计算过程)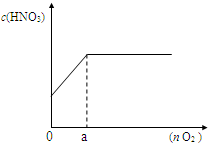
参考答案:(1)因为铁粉有剩余,所以溶液中存在的一定是Fe(NO3)2
本题解析:
本题难度:一般
3、选择题 下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④ S ⑤H+ ⑥Cu2+ ⑦Mg
A.①⑦
B.②④
C.③⑤⑥
D.②④⑤⑥
参考答案:C
本题解析:
试题分析:氧化性反映在电子的得失上,应该是得到电子,化合价降低,体现氧化性。因此凡是凡是元素化合价处于最低价的就只能失去电子,体现还原性。反之处于最高价的就只能得到电子,体现氧化性,而处于中间价态的则既能能得到电子,体现氧化性,也能失去电子体现还原性。据此可以判断选项C正确,①、⑦只有还原性,②、④既有氧化性,也有还原性,所以正确的答案选C。
点评:氧化性和还原性的判断关键是准确记住常见元素的化合价不能灵活运用。
本题难度:一般
4、选择题 某醇6.2g与足量Na反应,放出H2?2.24L(标准状况),则此醇的结构简式可能是( )
A.CH3CH2OH
B.CH3OH
C.CH2OHCHOHCH2OH(丙三醇)
D.HOCH2CH2OH
参考答案:D
本题解析:
本题难度:一般
5、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)?△H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)???△H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=??kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作?????????极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是??????????(写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为???????????????。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。

①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为??????????????。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为???????(任写一个)。
参考答案:
(1)①-217.4;②阳;
(2)①H3PO
本题解析:
试题分析:①根据盖斯定律,可通过已知方程式1与方程2相加后除以3可得目标热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ·mol-1。②粗铜精炼是电解原理的运用,只有粗铜做阳极时,纯铜做阴极才能提纯。(2)在反应:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4?中,①该反应还原剂是化合价升高的物质,即为H3PO2。②该反应每转移3mol电子,生成CuH的物质的量为1mol。(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的
本题难度:困难