微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在HAc H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
A.加HAc
B.加NaAc
C.加水
D.加NaOH
2、选择题 室温下,对于醋酸及其盐的下列判断正确的是

A.稀醋酸溶解石灰石的离子方程式为
CaCO3+2H+=Ca2++H2O+CO2↑
B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大
C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图
D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同
3、填空题 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈?????????(填“弱酸性”、“中性”或“弱碱性”),原因是:???????(用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式:??????????????????;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是?????。(填编号)???????????
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1
B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度????0.01mol·L-1(填“>” “="”" 或“<”)。
4、填空题 (8分)SO2、NO是大气污染物。工业上吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
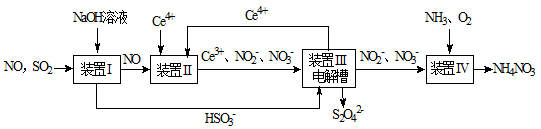
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为 ;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为 、 、过滤、洗涤等。
5、选择题 分别用pH=2和pH=3的醋酸溶液中和等物质的量的苛性钾溶液,消耗两种醋酸溶液的体积分别为V1和V2,V1和V2的关系正确的是( )
A.V2=10V1
B.V1>10V2
C.V2<10V1
D.V2>10V1