微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:

催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).
该反应的△H=______.催化反应室中采用300℃的反应温度,理由是______.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol?CO、3mol?H2和2mol?CH3OH充入容积为2L的密闭容器中,此时反应将______(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为______.
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为______.
参考答案:(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H
本题解析:
本题难度:简单
2、填空题 煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g) =CO2(g);ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g) =H2O(g);ΔH=E3 ③
CO(g)+1/2O2(g) =CO2(g);ΔH=E4 ④
(1)与途径a相比,途径b有较多的优点,即______________________ 。
(2)上述四个热化学方程式中ΔH>0的反应有__________________________ 。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是_____________ 。
A.a比b多 B.a比b少 C.a与b在理论上相同 D.两者无法比较
(4)根据能量守恒定律,E1、E3、E4之间的关系为_________________________。
参考答案:(1)煤的利用率高,变成气体燃料后,运输方便,使燃料充 91exam.org分燃烧
本题解析:
本题难度:一般
3、选择题 已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s) △H=-351.1 kJ/mol
Hg(l)+1/2O2(g)=HgO(s) △H=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H为
[???? ]
A.-441.8 kJ/mol
B.-254.6kJ/mol
C.- 438.9 kJ/mol
D.- 260.4 kJ/mol
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知:H2O(g)═H2O(l)△H1=-Q1kJ?mol-1(Q1>0)
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
参考答案:D
本题解析:
本题难度:简单
5、选择题 根据碘与氢气反应的热化学方程式:
H2(g)+I2(g)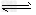 2H?I(g)ΔH=–26.48kJ/mol①
2H?I(g)ΔH=–26.48kJ/mol①
H2(g)+I2(s)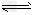 2H?I(g)ΔH=+9.48kJ/mol?②
2H?I(g)ΔH=+9.48kJ/mol?②
下列判断正确的是 [???? ]
A.254g?I2(g)中通入2gH2(g),反应放热26.48kJ
B.反应②的反应物总能量比反应①的反应物总能量低
C.反应①是放热反应,说明该反应在常温下很容易发生
D.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
参考答案:B
本题解析:
本题难度:一般