微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
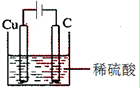
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。

(3)实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验

用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。
参考答案:(1)Cu+2H2SO4=CuSO4+SO2↑+2H2O
本题解析:(1)无现象的是盐酸,有刺激性气味气体生成的是浓硫酸,有红棕色气体生成的是浓硝酸。
Cu+2H2SO4=CuSO4+SO2↑+2H2O
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
(2)
(3)① 配制2.0mol·L-1的稀硫酸500mL,还需要的仪器是500mL容量瓶、胶头滴管
②下列操作中造成所配溶液浓度偏低的是C
(4)①装置A的试管中发生反应的化学方程式:2NH4Cl+Ca(OH)2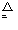 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
装置B的烧瓶内发生反应的化学方程式:2H2O2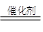 H2O+O2↑
H2O+O2↑
②下列关于A、B装置的叙述不正确的是:C
③玻璃管内发生反应的化学方程式:4NH3+5O2=4NO+6H2O
该结论不严密,氨气过量时,可与硝酸反应生成NH4NO3,NH4NO3水解显酸性。
本题难度:简单
2、实验题 某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
?
| 实验操作
| 实验现象
|
步骤1
| 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份
| 有少量气泡产生,溶液的黄绿色褪去
|
步骤2
| 将第一份滤液与稀盐酸混合
| 产生大量气泡
|
步骤3
| 将第二份滤液加热
| 溶液变浑浊,且有大量无色气体产生
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是???????????????????????;为达到该实验目的,还可以采取的方法是??????????????????????????????????。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:?????????????????????????????????????????????????????????????。
参考答案:
⑴除去碳酸钙等不溶性杂质
⑵检验HCO3—离子
本题解析:⑴除去碳酸钙等不溶性杂质
⑵检验HCO3—离子?另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
本题难度:一般
3、填空题 磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:

已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是????????????????????????????? 。
(2)TiO2+水解生成H2TiO3的离子方程式为?????????????????????????????????? 。
(3)加入NaClO发生反应的离子方程式为????????????????????????????????????? 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 ????????????。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 ?????????????????????????????????。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
参考答案:(1)增大固体的表面积,加快化学反应速率
(2)TiO
本题解析:(1)粉碎的目的是增大固体与溶液反应时的接触面积,加快反应的进行。
(3)酸性条件下ClO-将Fe2+氧化为Fe3+,ClO-被还原成Cl-:ClO-+2Fe2++2H+ Cl-+2Fe3++H2O。 Cl-+2Fe3++H2O。
(4)滤液浑浊,说明过滤器损坏,应换上新过滤器后,重新过滤。
(5)如果未用标准液润洗滴定管,会导致标准液被稀释,消耗KMnO4标准液体积偏大,使测定结果偏高;当滴定达终点时,滴加最后一滴KMnO4标准液,溶液变成紫红色,且半分钟内不褪色。由Mn ~5Fe2+知, ~5Fe2+知,
w(Fe)=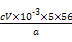 ×100%= ×100%=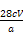 %。 %。
本题难度:困难
4、选择题 下列实验装置不适用于物质分离的是[???? ]
A.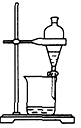
B.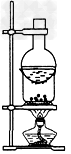
C.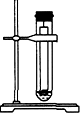
D.
参考答案:D
本题解析:
本题难度:简单
5、选择题 为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号
| 物质
| 杂质
| 除杂质应选用的试剂或操作方法
| ①
| KNO3溶液
| KOH
| 滴入稀盐酸,同时用pH计测定至溶液呈中性
| ②
| FeSO4溶液
| CuSO4
| 加入过量铁粉并过滤
| ③
| H2 ?
| CO2
| 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
| ④
| Na2SO4
| CaCO3
| 溶解、过滤、蒸发、结晶
A.①②③???? B.②③④???? C.①③④???? D.①②③④
参考答案:B
本题解析:考查物质的分离和提纯。选项①中加入盐酸后氢氧化钾转化为氯化钾,因此又引入了新的杂质,①不正确,其余都是正确的,答案选B。
本题难度:一般
|
|