微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原性铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
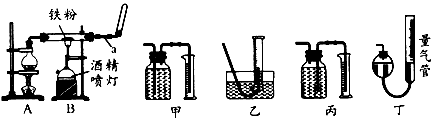
(1)仪器a的名称是________;烧瓶中所放的固体是____________。
(2)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成的气体的体积,计算铁粉的转化率。
①该同学应该先点燃____(填“A”或“B”,下同)处的酒精灯(或酒精喷灯),一段时间后,再点燃
____ 处的酒精灯(或酒精喷灯);测量气体体积不可以选用上图中的____(填“甲”“乙…"丙”或“丁”)装置;
②称取1.0g 铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为44.8
mL,则铁粉的转化率为________。
(3)为了分析反应后的固体混合物中是否含有+3价的Fe,该同学将反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色。请你在下表中将该同学滴加KSCN溶液后观察到的现象补充完整,并写出相应的结论与解释。

2、实验题 ?(16分)某化学研究小组为证明CO具有还原性,首先查阅相关资料,获取下列信息:
①? ;
;
②CO和H2都可在加热条件下与CuO反应;
③CO有剧毒,在空气 中可以燃烧。
中可以燃烧。
根据以上信息和有关知识,他们设计了如图所示的实验装置。
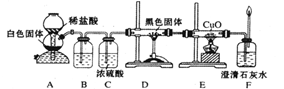
试回答下列问题:
(1)装置A中反应的离子方程式是______________???。
(2)装置B.中最适宜的试剂是_______;必须用装 置C吸收气体中水蒸气的理由是_
置C吸收气体中水蒸气的理由是_ ______。
______。
(3)按照如图装置进行实验时,首先应进行的操作是检查气密性,并要排净整套装置中的空气,则排净装置中空气的必要性是______ ???????????????????????????????????????????????????????????????????
(4)??????根据该实验中的_______现象,可证明CO具有还原性,有关反应的化学方程式为______________。
(5)??????若要根据装置F中石灰水变浑浊的现象确认CO具有还原性,则应在上图装置_______与_______之间连接右图中的_______装置(填序号)。
3、填空题 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH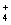 +6HCHO=3H++6H2O+(CH2)6N4H+???[滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+???[滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I??称取样品1.500g。
步骤II?将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ?移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填 “偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察[???]
A.滴定管内液面的变化?? B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由???????色变成 ????????色。
(2)滴定结果如下表所示:
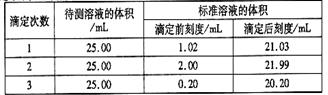
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为????????
4、实验题 为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积)
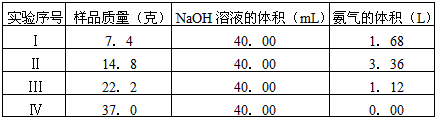
(1)实验过程中有关反应的离子方程式为:__________________________。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为__________________。
(3)计算确定该混合物中(NH4)2SO4和NH4HSO4的物质的量之比______________。
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度
为_____________。
5、实验题 下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置
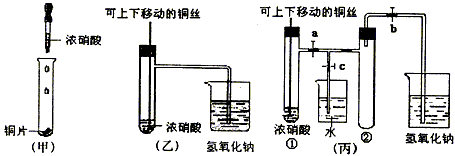
(1)写出铜和浓硝酸反应的离子方程式__________________________。
(2)和甲装置相比,乙装置的优点有____________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置,做实验时先关闭弹簧夹_________,再打开弹簧夹_________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作________________________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_________________(气体体积按标准状况计算)。