微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。
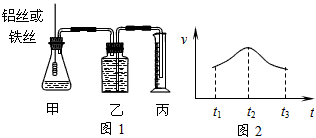
(1)检查图1装置气密性的方法是______________________________________。
(2)若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1~t2时间内反应速率逐渐加快的主要原因是_______________________________________。
参考答案:(1)用手捂住锥形瓶,观察乙中长导管内液面是否上升
本题解析:
本题难度:一般
2、填空题 将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g)??? ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g)??? ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题:
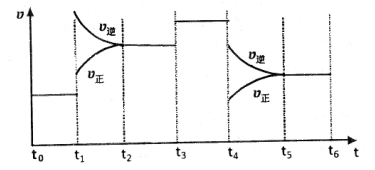
①处于平衡状态的时间段是____________。
② 、
、 、
、 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?
 ___________、
___________、 _____________ 、
_____________ 、 _____________(填A-E)
_____________(填A-E)
A.升温???? B.降温 ????C.加催化剂???? D.加压????E.减压
③下列各时间段时,A的体积分数最高的是____
A.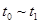 ??????? B.
??????? B.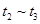 ??????? C.
??????? C.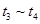 ??????? D.
??????? D.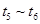
参考答案:(1)1 (2)0.5mol/L?(3)9:10??(4)①
本题解析:
试题分析:(1)V(C)=ΔC/Δt所以ΔC=" V(C)×Δt=0.05mol/(L·min)" ×5min="0.25" mol/L。在反应中C(C):C(D)=X:2? 0.25: 0.5= X:2,所以X=1.(2)ΔC(A):ΔC(D)=3:2? ΔC(A): 0.5=3:2.? ΔC(A)=0.75。假设开始时加入的A、B的物质的量为2m,则起始时A、B的物质的量浓度为m mol/L.根据反应变化的A 浓度为0.75 mol/L和反应方程式中A、B的系数关系可知反应变化的B浓度为0.2
本题难度:一般
3、选择题 下列说法正确的是( )
①为加快锌粉与稀硫酸制氢气的反应速率,可以加入少量的CuCl2固体
②面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
③2molSO2与1molO2混合反应后一定能生成2molSO3
④煤的干馏、石油的裂化、乙烯生产聚乙烯均属于化学变化
⑤压缩天然气、液化石油气这两类燃料的主要成分都是烃类.
A.①②③④⑤
B.②③④⑤
C.①③④⑤
D.①②④⑤
参考答案:①加入少量的CuCl2固体,锌置换出铜,可形成原电池反应,加
本题解析:
本题难度:简单
4、实验题 (16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
编号
| H2C2O4溶液
| KMnO4溶液
| 硫酸溶液
| 温度/℃
|
| 浓度
(mol/L)
| 体积
(mL)
| 浓度
(mol/L)
| 体积
(mL)
|
|
|
①
| 0.10
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 25
|
②
| 0.20
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 25
|
③
| 0.20
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 50
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
参考答案:(1)②③ ;①② ;(2)MnSO4&
本题解析:
试题分析:(1)对表格中的数据进行观察得知:探究温度对化学反应速率影响的组合实验编号是②③;探究反应物浓度对化学反应速率影响的组合实验编号是①②;(2)由于在反应过程中产生了MnSO4,因此可推断出反应混合溶液中的MnSO4也加速了此反应的进行。(3)①由于反应后溶液中H2C2O4过量,即溶液显酸性,所以取用反应酸性混合液的滴定管用酸式滴定管;②A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数,则读数偏小,使测出的H2C2O4剩余量比理论值偏低,正确;B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥,不能产生任何误差,错误;C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失,则消耗的KMnO4溶液体积偏大,因此使测出的H2C2O4剩余量比理论值偏高;错误;D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液,则消耗的标准KMnO4溶液体积偏大,因此使测出的H2C2O4剩余量比理论值偏高;错误。③由于KMnO4溶液是紫色的,当与草酸反应后产物是无色的,因此就可以利用其本身的颜色变化来显示滴定终点,故此滴定实验不需要滴加指示剂;滴定的终点的判断方法是当加入最后一滴酸性KMnO4溶液时,锥形瓶内溶液由无色变为浅紫色,且30s内不褪色。就达到了滴定终点。
考点:考查外界条件对化学反应速率的影响、滴定法在测定物质的组合、指示剂的选择、滴定终点的判断。
本题难度:困难
5、选择题 设C+CO2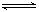 2CO-Q1,反应速率V1;N2+ 3 H2 2CO-Q1,反应速率V1;N2+ 3 H2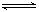 2NH3+Q2反应速率V2 。对于上述反应,当温度升高时,V1和V2的变化情况为(????) 2NH3+Q2反应速率V2 。对于上述反应,当温度升高时,V1和V2的变化情况为(????)
A.同时增大
B.同时减小
C.V1增大,V2减小
D.V1减小,V2增大
参考答案:A
本题解析:考查外界条件对反应速率的影响。只要升高温度,反应速率就一定加快,所以答案选A。
本题难度:一般
|