微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
参考答案:(1)7 (2)CH3CO
本题解析:(1)醋酸钠溶液盐酸,发生反应CH3COONa+HCl=CH3COOH+NaCl。根据物质的量可知,醋酸钠过量,即溶液中含有0.006mol醋酸钠、0.004mol醋酸和0.004mol氯化钠。醋酸存在电离平衡,醋酸钠存在水解平衡,所以含有的微粒是CH3COOH、H2O、H+、OH-、CH3COO-、Na+、Cl-共计是7种。
(2)根据原子守恒可知,CH3COOH和CH3COO-的物质的量之和一定等于0.01mol。
(3)根据电荷守恒可知n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),所以n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.01mol-0.004mol=0.006mol。
本题难度:困难
2、填空题 (14分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
上述盐溶液中的阴离子,结合H+能力最强的是_______ _,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1 mol/L NaHCO3 ②100ml 0.1 mol/L Na2CO3两种溶液,溶液中水电离出的H+个数:
① ②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:① ②
(3)NaHCO3是一种 (填“强”或“弱”)电解质;写出HCO3
参考答案:
本题解析:
本题难度:困难
3、选择题 下列有关化学用语表达正确的是
A.碳酸氢根离子的水解方程式:HCO3-+H2O H3O++CO32- H3O++CO32-
B.聚丙烯的结构简式: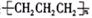
C.钾原子的结构示意图:
D.甲烷分子的比例模型:
参考答案:D
本题解析:
试题分析:A、 碳酸氢根离子的水解方程式应为HCO3-+H2O H2CO3+OH-;B、聚丙烯的结构简式为 H2CO3+OH-;B、聚丙烯的结构简式为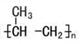 ,错误;C、钾原子的结构示意图为 ,错误;C、钾原子的结构示意图为 ,错误;D、甲烷的比例模型为 ,错误;D、甲烷的比例模型为 ,正确;故本题选择D。 ,正确;故本题选择D。
考点:化学用语的描述
本题难度:一般
4、选择题 H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-) B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A) D.c(K+)=c(H2A)+c(HA-)+c(A2-)
参考答案:CD
本题解析:
试题分析:在0.1mol·L-1 KHA溶液中,根据电荷守恒可以得到,c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故A错误,根据物料守恒,可以得到c(HA-)+c(A2-)+c(H2A)=0.1mol·L-1,故B错误,因为KHA溶液呈酸性,所以HA-的电离大于水解,故c(A2-)>c(H2A) ,所以C正确,根据物料守恒可以得到c(K+)=c(H2A)+c(HA-)+c(A2-) ,故D正确,所以本题的正确答案选择CD。
考点:电荷守恒、物料守恒
点评:本题考查水溶液中的电荷守恒、物料守恒,该知识点是高考考查的重点和难点,本题难度适中。
本题难度:困难
5、填空题 写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF ;
(3)K2CO3 ; ;
参考答案:(1)Fe3+ +3H2O  本题解析:(1)多元弱碱阳离子一步水解 本题解析:(1)多元弱碱阳离子一步水解
(3)多元弱酸的酸根离子要分多步水解
本题难度:一般
|