微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)
参考答案:
本题解析:
本题难度:一般
2、选择题 若在铜上镀银时,下列叙述正确的是(???)
①将铜片与电源的正极相连;②将银片与电源的正极相连;③在铜片上发生的反应是Ag++e- →Ag;④在银片上发生的反应是4OH-→2H2O+O2↑+4e-;⑤需CuSO4溶液作电镀液;⑥需AgNO3溶液作电镀液。
A.①③⑥
B.①④⑤
C.②③⑥
D.①②④⑥
参考答案:C
本题解析:依据电镀的原理知,铜片作阴极,与电源的负极相连,发生的反应是Ag++e- →Ag;银片作阳极,电镀液为AgNO3溶液。
本题难度:简单
3、选择题 在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为
A.1mol?L-1
B.2mol?L-1
C.3mol?L-1
D.4mol?L-1
参考答案:A
本题解析:
试题分析:2.24L标况下气体的物质的量为0.1mol,用石墨做电极电解100mLH2SO4和CuSO4的混合液,电极反应为:阳极:4OH--4e-=2H2O+O2↑,阴极:Cu2++2e-=Cu 2H++ 2e = H2↑,
0.4 0.1 x 2x 0.2 0.1
根据电解池中,两极放电量相等,0.4=2x+0.2 解得x=0.1mol,则原混合液中,Cu2+的物质的量浓度为0.1/0.1=1mol/L,选A。
考点:考查电解的计算。
本题难度:一般
4、填空题 甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol?L-1)变化如下表所示:(前6min没有改变条件)
| 2min
| 4min
| 6min
| 8min
| …
|
CO
| 0.07
| 0.06
| 0.06
| 0.05
| …
|
H2
| x
| 0.12
| 0.12
| 0.2
| …
|
CH3OH
| 0.03
| 0.04
| 0.04
| 0.05
| …
①x= 。
②250℃时该反应的平衡常数K值为: (不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是 。
④第8min时,该反应是不是达到平衡状态 。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ. 。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极: 。
参考答案:(1)-93.0 KJ/mol (3分)
(2)①x=
本题解析:
试题分析:(1)根据盖斯定律,②=①-(③+④),所以ΔH2=ΔH1-(ΔH3+ΔH4)=-93.0 KJ/mol;
(2)①CO在2~4min浓度减少0.01mol/L,则H2的浓度减少0.02mol/L,4min时氢气的浓度是0.12mol/L,所以x=0.02mol/L+0.12mol/L=0.14 mol/L;
②250℃时在6min时达平衡,根据平衡常数的计算式得K=
③8min时CO的浓度减小,氢气的浓度增大,甲醇的浓度增大,说明改变条件平衡正向移动,CO浓度减少0.01mol/L,则氢气的浓度减少0.02mol/L,所以改变条件时氢气的浓度是0.22mol/L,与6min时相比氢气的浓度增加0.1mol/L,物质的量增加1mol,所以改变的条件是氢气增加1mol;
④用8min时生成物的浓度幂除以反应物的浓度幂之积,与 相比,若相等则是平衡状态,若不等则不是平衡状态; 相比,若相等则是平衡状态,若不等则不是平衡状态;
⑤温度太低,反应速率小,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低,所以温度以催化剂的活性为主进行选择;
(3)电解甲醇水溶液比电解相同物质的量的水多,电解1molH2O得1mol氢气,则电解1mol甲醇水溶液产生的氢气将大于1mol,所以电解1mol甲醇水溶液产生的H+将大于2mol,说明甲醇分子中的氢原子通过电解液成为H+,故电解甲醇水溶液的阳极反应式为CH3OH+H2O-6e-=6H++CO2↑。
考点:考查盖斯定律的应用,化学平衡的有关计算,对反应条件的分析,用平衡常数判断平衡状态,电解原理的应用
本题难度:困难
5、简答题 某实验的实验装置如图所示,回答下列有关该实验的问题.
(1)该实验所用的石墨棒须经过预处理:先经高温火焰灼烧到红热,再迅速浸入冷水中.这种预处理的目的是______.
(2)要使发光二极管发亮,实验时的操作顺序是______.
(3)断开S1,闭合S2后的各电极的反应式______.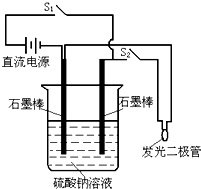
参考答案:(1)如果石墨棒表面光滑,生成的气体在电极上无法保存,所以不
本题解析:
本题难度:一般
|