微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数的值.下列叙述正确的是
A.17g甲基(-14CH3)所含中子数为9NA
B.标准状况下,密度为ρg?L-1的某气体纯净物一个分子的质量为g
C.25℃时,1?L?pH=13的NaOH溶液中含有NA个氢氧根离子
D.常温下,0.2molCl2溶于等体积水中,转移电子数为0.2?NA
参考答案:B
本题解析:分析:A.1个甲基由1个碳原子和三个氢原子构成,1个14C中含6个质子,8个中子;
B.1mol物质的分子数为NA,标准状况下,1mol气体的体积为22.4L;
C.pH是指溶液中氢离子浓度的负对数,pH=-lg c(H+);
D.Cl2溶于水中,发生的反应为:Cl2+H2O?HCl+HClO,该反应为可逆反应;
解答:A.17g甲基的物质的量:n=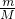 =
=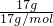 =1mol,1个14C中含6个质子,8个中子,1个氢原子含1个质子和0个中子,1mol甲基含中子为8NA,故A错误;
=1mol,1个14C中含6个质子,8个中子,1个氢原子含1个质子和0个中子,1mol甲基含中子为8NA,故A错误;
B.假设取1mol气体,在标准状况下,该气体的体积为22.4L,密度为ρg?L-1,1mol气体的质量为22.4ρg,1mol物质的分子数为NA,一个分子的质量为22.4ρNAg,故B正确;
C.25℃时,pH=13的NaOH溶液中含有氢离子浓度为PH=-lg c(H+)=13,c(H+)=10-13mol/L,c(0H-)=10-1mol/L,1?L溶液,含有0.1NA个氢氧根离子,故C错误;
D.Cl2+H2O?HCl+HClO中得到的电子为Cl2~HCl~e-,失去的电子为Cl2~HClO~e-,1molCl2完全反应,转移1mol电子,0.2molCl2转移的电子数为0.2NA,但该反应为可逆反应,转移电子数应小于0.2NA,故D错误;
故选B.
点评:该题涉及的重要的知识点较多,考查了可逆反应、气体摩尔体积、pH的计算、中子数与质量数间的关系,平时学习应关注这些重要的知识点,方可轻松解题.
本题难度:一般
2、选择题 相同状况下,下列气体所占体积最大的是
A.80g?SO3
B.3g?H2
C.16g?O2
D.34g?H2S
参考答案:B
本题解析:分析:根据V= 计算气体的体积.
计算气体的体积.
解答:相同条件下,Vm相同,根据V= 知,气体体积取决于质量和摩尔质量的比值,
知,气体体积取决于质量和摩尔质量的比值,
A.80gSO3的体积= =Vm;
=Vm;
B.3gH2的体积= =1.5Vm;
=1.5Vm;
C.16g?O2的体积=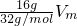 =0.5Vm;
=0.5Vm;
D.34gH2S的体积=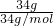 Vm=Vm;
Vm=Vm;
所以气体体积最大是氢气,
故选B.
点评:本题考查阿伏伽德罗定律及其推论,明确气体体积、质量、摩尔质量之间的关系是解本题的关键,难度不大.
本题难度:一般
3、选择题 现将20%的H2SO4溶液与30%的H2SO4溶液等体积混合,所得溶液的质量分数为n,则n值
A.等于25%
B.大于25%
C.小于25%
D.无法确定大小
参考答案:B
本题解析:设20%H2SO4溶液的密度为ρ1g·cm-3,30%H2SO4溶液的密度为ρ2g·cm-3,各取V mL混合,则有下面关系:
n=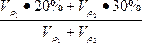
n=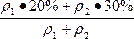
当ρ1=ρ2时,n=25%
当ρ1<ρ2时,n>25%
当ρ1>ρ2时,n<25%
H2SO4溶液浓度越大,密度越大,ρ1<ρ2,故n>25%。
具体推导可用以下方法:
方法一
n-25%=![]() -25%=
-25%=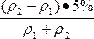
因为ρ2>ρ1,所以上式大于0,即n>25%。
方法二
n=![]() =
=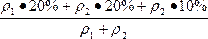 =20%+
=20%+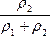 ·10%
·10%
因为ρ2>ρ1,所以![]() >
> ,
,![]() ·10%>5%,即n>25%。
·10%>5%,即n>25%。
本题难度:简单
4、选择题 配制100mL2mol/L的Na2CO3溶液,应称量Na2CO3的质量为
A.21.2g
B.20.1g
C.212g
D.201g
参考答案:A
本题解析:分析:由n=cV、m=nM来计算.
解答:配制100mL2mol/L的Na2CO3溶液,n=0.1L×2mol/L=0.2mol,
Na2CO3的质量为0.2mol×106g/mol=21.2g,
故选A.
点评:本题考查物质的量浓度的简单计算,明确质量、物质的量、摩尔质量、浓度之间的关系即可解答,题目较简单.
本题难度:一般
5、选择题 下列化合物中,既有离子键,又有共价键的是
A.Na2O2
B.NH3
C.CaCl2
D.HCl
参考答案:A
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。A中含有离子键和非极性键,B和D中只含有极性键,C只只有离子键,所以答案选A。
本题难度:简单