微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中微粒的物质的量浓度关系正确的是[???? ]
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.室温下,向0.01mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
参考答案:D
本题解析:
本题难度:一般
2、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
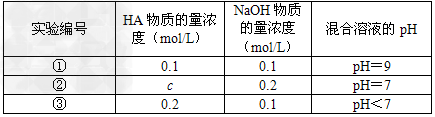
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?____________(填“强酸”或“弱酸”)
(2)②组情况表明,c____________0.2?mol/L(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是____________。
(3)从③组实验结果分析,说明HA的电离程度_________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是____________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
参考答案:(1)弱酸
(2)大于;c(A-)
本题解析:
本题难度:一般
3、选择题 在无色的强碱性溶液中,能大量共存的是
A.Na+、Al3+、NO3-、Cl-
B.K+、Na+、Cl-、AlO2-
C.Fe2+、K+、SO42-、Cl-
D.Na+、HCO3-、K+、NO3-
参考答案:B
本题解析:分析:溶液无色,则有颜色的离子组,不符合要求,溶液呈强碱性,溶液中含有大量的OH-离子,与OH-离子反应的Al3+、HCO3-不能大量共存.
解答:A、溶液呈强碱性,溶液中含有大量的OH-离子,OH-离子与Al3+离子反应,不能大量共存,故A错误;
B、四种离子均无颜色,且在碱性条件下离子之间不发生任何反应,能够大量共存,故B正确;
C、Fe2+离子有颜色,不符合溶液无色的要求,且Fe2+离子与OH-离子生成沉淀,故C错误;
D、溶液呈强碱性,溶液中含有大量的OH-离子,OH-离子与HCO3-离子反应,不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,题目难度不大,注意本题溶液无色及溶液呈碱性的要求.
本题难度:一般
4、选择题 下列反应中属于氧化还原反应,又是离子反应的是
A.铁和稀硫酸反应
B.碳和氧化铁高温反应
C.氢气在氧气中燃烧生成水
D.氧化铁与盐酸反应
参考答案:A
本题解析:
试题分析:凡是有元素化合价升降的反应是氧化还原反应,有离子参加或生成的反应是离子反应。A、铁和稀硫酸反应属于氧化还原反应,又是离子反应,A正确;B.碳和氧化铁高温反应属于氧化还原反应,但不是离子反应,B不正确;C.氢气在氧气中燃烧生成水属于氧化还原反应,但不属于离子反应,C不正确;D.氧化铁与盐酸反应属于离子反应,但不是氧化还原反应,D不正确,答案选A。
本题难度:一般
5、选择题 下列说法正确的是(???)
A.硫酸钡难溶于水,其水溶液导电能力极弱,所以硫酸钡不是电解质
B.CO2溶于水得到的溶液能导电,所以CO2是电解质
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离
参考答案:D
本题解析:硫酸钡是电解质,电解质与化合物的溶解性无关,也与其溶液的导电能力无关,故A错误;CO2本身在水溶液中不能电离,能电离的为碳酸,故CO2不是电解质,所以B项错误;酸、碱和盐类都属于电解质,而水不属于酸、碱和盐类,但它都属于电解质,故C项错误。
本题难度:简单