1.3×10-36mol2·L-2
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
参考答案:(1)AgBr>AgI>FeS>ZnS&g
本题解析:
试题分析:(1)AgBr、AgI、FeS、ZnS、CuS结构相似,溶度积越大,溶解能力越强,AgBr>AgI>FeS>ZnS>CuS;(2)碘化银的溶度积不变,加入硝酸银,银离子浓度增大,所以[I-]减小;AgBr的溶度积大于碘化银的溶度积,所以加入AgBr,[Ag+]增大;(3)最先生成溶度积小的物质,生成的沉淀的先后顺序是CuS、ZnS、FeS;(4)ZnS 的溶度积大于CuS,故A错误;ZnS 的溶度积小于FeS,FeS 能转化为ZuS,故B错误;加入少量FeCl2固体,生成FeS,ZnS减少,故C正确;加入少量CuCl2固体,生成CuS,ZnS减少,故D正确;
考点:本题考查溶解沉淀平衡。
本题难度:困难
2、选择题 下列有关物质的制备和转化正确的是
A.常温下,用铝与浓硫酸反应制备二氧化硫
B.氯化钡溶液中通入二氧化硫可生成BaSO3沉淀
C.用FeS除去废水中的重金属铜离子
D.以粗铜作阴极,硫酸铜溶液为电解质溶液电解精炼铜
参考答案:C
本题解析:
试题分析:常温下,用铝遇浓硫酸钝化,故常温下,不能用铝与浓硫酸反应制备二氧化硫,A项错误;氯化钡溶液中通入二氧化硫,二者不反应,故B项错误;CuS比FeS更难溶,故可用FeS除去废水中的重金属铜离子,C项正确;电解精炼铜,粗铜做阳极,故D项错误。
考点:物质反应转化。
本题难度:一般
3、选择题 下列化学实验事实及其结论中有错误的是 [???? ]
A.向碘水中滴加CCl4,振荡后静置,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸和Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于酸
C.向麦芽糖溶液中加入适量银氨溶液水浴加热有银镜生成,说明麦芽糖分子中有醛基
D.向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L? AgNO3溶液,振荡后沉淀呈黄色,证明Ksp(AgCl)>Ksp(AgI)
参考答案:B
本题解析:
本题难度:一般
4、填空题 运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10??KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答)??????????????????????????,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是????????????,产生该现象的原因是(用离子方程式表示)??????????????????。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是???????(填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2 ??
B.2NH4HSO4 (NH4)2S2O8 + H2↑ (NH4)2S2O8 + H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
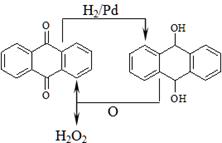
D.乙基蒽醌法见下图
(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。
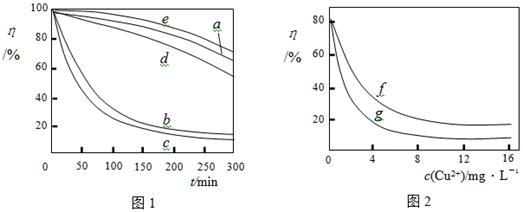
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是??????????????????(填序号)。
A.锰离子能使该降解反应速率减缓?????
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
参考答案:(10分)
(1)Q (AgCl)= c(Ag+)·c
本题解析:
试题分析:(1)Q (AgCl)= c(Ag+)·c (Cl-)= 1×l0-6>Ksp(AgCl)。KSP(AgI)=1.5×l0-16>Q (AgCl),故白色沉淀转化为黄色沉淀。离子方程式是:AgCl(s) + I-(aq) ==? AgI(s) + Cl-(aq)。
(2)原子利用率最高的是反应物都转化为生成物或有些反应物又重新变为生成物再反应,故错D。
(3)B项:H2O2具有氧化性而Fe2+具有还原性,之间发生了氧化还原反应,故亚铁离子对该降解反应的催化效率比铜离子低
本题难度:一般
5、选择题 下列说法正确的是( )
A.向饱和食盐水中加入少量的浓盐酸,看不到明显的现象
B.将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小
C.在0.01 mol·L-1 NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解
D.CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3 Ca2++ CO32- Ca2++ CO32-
参考答案:B
本题解析:
试题分析:A项有NaCl晶体析出,A错误;C中AgCl(s) Ag+(aq)+Cl-(aq),加入浓氨水后生成[Ag(NH3)2]+,沉淀溶解平衡右移,白色沉淀会溶解,C错误;选项D中,溶液的导电性只与离子浓度和离子所带电荷有关,CaCO3溶液的导电能力很弱是因为CaCO3溶解度很小,但CaCO3是强电解质,D错误。 Ag+(aq)+Cl-(aq),加入浓氨水后生成[Ag(NH3)2]+,沉淀溶解平衡右移,白色沉淀会溶解,C错误;选项D中,溶液的导电性只与离子浓度和离子所带电荷有关,CaCO3溶液的导电能力很弱是因为CaCO3溶解度很小,但CaCO3是强电解质,D错误。
考点:难溶电解质的溶解平衡
本题难度:一般
|