微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
Cr42-
H+
①转化
CrO72-Fe2+
②还原
Cr3+OH-
③沉淀
Cr(OH)3↓
2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O
①Cr2O72-中Cr的化合价是______.
②若平衡体系的pH=10,则溶液显______色.
(2)第②步发生反应的离子方程式为______,还原1molCr2O72-离子,需要______mol的FeSO4?7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
参考答案:(1)①Cr2O72-中O的化合价为-2价,由离子中元素化合
本题解析:
本题难度:简单
2、选择题 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S) Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少
B.溶液c(Ca2+)减小
C.溶液的C(OH-)增大
D.溶液中溶质的质量分数增大
参考答案:A
本题解析:
试题分析:生石灰溶于水,和水生成氢氧化钙。由于溶液是饱和溶液,属于生成的氢氧化钙不能溶解。又因为溶剂减少,则原溶液中的氢氧化钙也会析出,但温度不变,溶液仍然是饱和溶液,所以选项A正确,其余都是错误的,答案选A。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的答题效率。
本题难度:一般
3、填空题 (14分)滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定 用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是 。
②上述滴定过程中操作滴定管的图示,正确的是 。
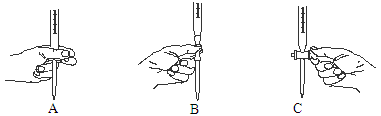
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH 溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定 用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是 (填字母序号)。

②判断滴定终点的依据是 。
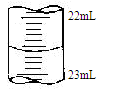
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)沉淀滴定 滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是 (填选项字母)。
难溶物
| AgCl
| AgBr
| AgCN
| Ag2CrO4
| AgSCN
|
颜色
| 白
| 浅黄
| 白
| 砖红
| 白
|
KSP
| 1.77×10-10
| 5.35×10-13
| 1.21×10-16
| 1.12×10-12
| 1.0×10-12
A、NaCl B、NaBr C、NaCN D、Na2CrO4
参考答案:(1)①锥形瓶 ② A&#
本题解析:
试题分析:(1)①进行酸碱中和滴定实验时,待测液要装在锥形瓶中,所以还缺少锥形瓶。②在进行滴定操作是时,要用左手控制酸式滴定管的活塞,所以A对,C错,挤压碱式滴定管的玻璃球时要往外挤压,B错。③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,对NaOH物质的量没有影响,所以再继续滴定至终点,盐酸的用量不变,故对所测得NaOH 溶液浓度没有影响。(2)①酸性高锰酸钾有强氧化性,要用酸式滴定管装,所以b对。②草酸溶液是无色的,高锰酸钾溶液是紫色的,所以滴定终点的现象为:当滴最后一滴高锰酸钾溶液时,溶液恰好由无色变浅紫红色,且半分钟内不褪色。③滴定后滴定管的读数为22.60mL,此时消耗标准溶液的体积为22.60mL-0.5 mL=22.10mL。(3)用AgNO3滴定NaSCN溶液生成的AgSCN是白色沉淀,为了现象明显,指示剂不能再是白色的,排除AgCl 和AgCN,在根据沉淀滴定的原理:滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。选D。
考点:酸碱中和滴定、氧化还原滴定和沉淀滴定的误差分析、指示剂的选择、滴定终点的判定等。
本题难度:困难
4、选择题 下列说法中不正确的是(????)
A.Ksp只与难溶电解质本身的性质和温度有关
B.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数
C.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大
D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀
参考答案:C
本题解析:
试题分析:Ksp只与难溶电解质本身的性质和温度有关,所以A正确,在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数,所以B也正确;在一定温度下,向AgCl饱和溶液中加入盐酸时,由于温度不变,所以Ksp值不变,所以C不正确,为本题的正确答案;由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀,故D正确。
点评:本题考查了溶解度,溶解度常数,考生要注意温度不变,物质的溶解度常数不变,本题比较容易。注意本题是选择说法不正确的。
本题难度:一般
5、填空题 (12分)某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。

已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
| Fe2+
| 6.34
| 9.7
| Fe3+
| 1.48
| 3.2
| Zn2+
| 6.2
| 8.0
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:
Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
参考答案:(1)适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等)(2)
本题解析:
本题难度:困难
|
|
网站客服QQ: 960335752 - 14613519 - 791315772