微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把足量熟石灰放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),下列叙述正确的是
Ca2+(aq)+2OH-(aq),下列叙述正确的是
A.给溶液加热,溶液的pH升高
B.恒温下向溶液中加入CaO,溶液的pH升高
C.向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
D.向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
参考答案:D
本题解析:氢氧化钙的溶解度随温度的升高而降低,所以加热溶液,有晶体析出,溶液的浓度降低,pH降低。溶液是饱和溶液,加热氧化钙后,氧化钙和水反应生成氢氧化钙。但由于温度不变,所以其浓度是不变的,B不正确。向溶液中加入Na2CO3溶液,会生成碳酸钙沉淀,促进溶解平衡向正反应方向移动,即Ca(OH)2固体减少,C不正确。向溶液中加入少量的NaOH固体,增大OH-的浓度,溶解平衡向逆反应方向移动,Ca(OH)2固体增多,D正确。答案选D。
本题难度:一般
2、填空题 研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:

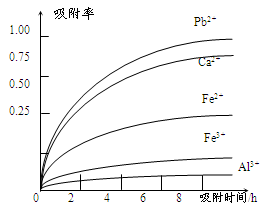
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀
时的pH
| 完全沉淀
时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
参考答案:(1)SO2+MnO2=MnSO4 (2)2Fe2
本题解析:
试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3。因此应调节pH的范围为4.7 ≤pH<8.3。(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;吸附步骤除去的主要离子为Pb2+、Ca2+。(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol/LCaCl2溶液与2.00×10—2 mol/LNa2SO4溶液等体积混合,由于忽略体积的变化,所以混合后氯化钙和硫酸钠溶液的浓度都要减半;c(SO42-)=1.00×10—2 mol/L. c(Ca2+)=c/2mol/L.由于Ksp(CaSO4)= 9.10×10—6,c(SO42-)·c(Ca2+)≥9.10×10—6,则生成沉淀时c(Ca2+)≥(9.10×10—6÷1.00×10—2 mol/L)×2=1.82×10-3mol/L。因此c的最小值是1.82×10-3mol/L.
考点:考查化学反应原理、影响离子吸收的因素及沉淀溶解平衡和溶度积的计算的知识。
本题难度:困难
3、选择题 已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2下列说法正确的是:
A.常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B.常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17mol2·L-2
C.常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D.向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
参考答案:C
本题解析:
试题分析:在常温下AgI饱和水溶液中,Ag+和I-浓度的乘积是一个常数,等于碘化银的溶度积常数,但非饱和溶液就不满足乘积关系,故A项错误;在常温下,在任何含AgI固体的溶液中,c(Ag+)不一定等于c(I-)但Ag+与I-浓度的乘积等于8.3×10-17 mol2·L-2,故B项错误;向AgI饱和溶液中加入AgBr固体,溶液中c(Ag+)增大Ksp值不变,则c(I-)减小,故D项错误;常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为:c=Ksp/c(Ag+)=[8.3×10-17 mol2·L-2/(0.5×10-2 mol/L)] ×2=3.32×10-14 mol/L,故C项正确。
考点:难溶电解质的溶度积常数。
本题难度:一般
4、选择题 许多马路两旁的树干都均匀地涂抹了石灰水。下列有关说法不正确的是[???? ]
A.饱和石灰水中加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变
B.饱和石灰水中加入生石灰,若温度不变,则pH不变
C.升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp减小
D.石灰水显碱性,能使蛋白质变性,所以有防治树木病虫害的作用
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42-
B.Ksp小的物质的溶解能力一定比Ksp大的物质的小
C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
D.洗涤沉淀时,洗涤次数越多越好
参考答案:C
本题解析:
试题分析:A.生成BaSO4沉淀后的溶液中仍然存在Ba2+和SO42-,因为有BaSO4的沉淀溶解平衡存在,A错误;B.同类型物质的Ksp数值越小,溶解能力越小,不同类型的物质则不能直接比较,B错误;C.从减小BaSO4沉淀损失的角度而言,用稀H2SO4洗涤效果好,因为H2SO4可以抑制BaSO4的溶解,C正确;D.洗涤沉淀一般2~3次即可,次数过多会使沉淀溶解而减少,D错误,选C。
考点:考查难溶电解质溶解平衡的应用。
本题难度:一般
|