微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,属于水解反应的是
[???? ]
A.HCOOH+H2O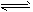 HCOO-+ H3O+
HCOO-+ H3O+
B.CO2+H2O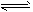 HCO3-+ H+
HCO3-+ H+
C.CO32-+H2O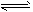 HCO3-+OH-
HCO3-+OH-
D.HS-+H2O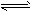 S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:
本题难度:简单
2、填空题 (10分)请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
参考答案:(1) Fe2O3 (2
本题解析:
试题分析:(1)加入氯化铁溶液,会促进水解,HCl不断挥发,导致最终得到Fe(OH)3,灼烧后得Fe2O3 ,(2)比较离子的浓度大小,分析物质的组成,且盐类的水解程度微弱,所以NH4+的离子浓度最大的是④,①中发生双水解,离子浓度最小,②中H+抑制水解,③电离程度小,所以离子浓度最小。(4)由已知条件确定该温度下水的离子积为10-12,当则R2+沉淀完全时,离子浓度小于10-5,结合物R(OH)2的Ksp = 1×10-13,c(OH-)=10-4mol/L,c(H+)=Kw/c(OH-)=10-8mol/L,所以pH为8.
考点:盐类的水解、离子浓度的大小比较、溶度积的计算。
本题难度:一般
3、填空题 纯水是一种极弱的电解质,它能微弱地电离出______和______;一般强酸弱碱所生成的盐,其水溶液呈______、强碱弱酸所生成的盐,其水溶液呈______、强酸强碱所生成的盐,其水溶液呈______.
参考答案:纯水是一种极弱的电解质,电离方程式为:H2O?H++OH-,
本题解析:
本题难度:一般
4、选择题 相同温度下等物质的量浓度的下列溶液中,NH4+值最小的是
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.(NH4)2SO4
参考答案:B
本题解析:
试题分析:氯化铵中,铵根离子的水解不受氯离子的影响;碳酸氢根离子水解显碱性,对铵根离子的水解起到促进作用,导致铵根离子水解程度大,铵根离子浓度减小;硫酸氢铵电离出来的氢离子对铵根的水解起抑制作用,导致铵根离子水解程度很小,铵根离子浓度增大;(NH4)2SO4氯化铵中,铵根离子的水解不受氯离子的影响。所以NH4+值最小的是NH4HCO3。
考点:考查影响盐类水解程度的主要因素。
本题难度:一般
5、填空题 酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:

回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
参考答案:(1)抑制Sn2+水解, 防止Sn2+被氧化 (2
本题解析:
试题分析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-
本题难度:困难