微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组设计了以下四个实验来探究氯水的成分,请根据下表回答问题:

(1)指出实验①的结论:_____________________________。
(2)指出实验②、③、④中的实验现象:②_____________;③___________;④________________。
(3)实验③中实验方法的具体操作过程是:____________________________。
(4)某同学认为产生实验②现象的原因是氯水加入到NaOH溶液中发生了中和反应,你是否同意这个观点:______________(填“同意”或“不同意”),请设计简单实验证明你的观点:__________________________________________________________。
2、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_________________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水b.铁粉和KSCN溶液 c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为____。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
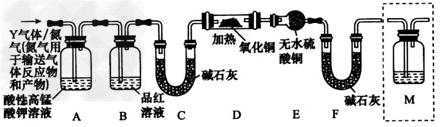
(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有CO2的理由是__________ (用化学方程式表示)。
(5)为确认CO2的存在,需在装置中添加M于____(填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是___________________
3、实验题 将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
猜想
| 实验操作
| 预期现象
|
猜想一:Fe元素只显______价
| ①向所得溶液中滴入KSCN溶液
②向稀酸性KMnO4溶液中滴入所得溶液
| KSCN溶液无明显现象
|
猜想二;Fe元素只显______价
| 稀酸性KMnO4溶液颜色_____
|
猜想三:Fe元素既有+2价又有+3价
| KSCN溶液呈______色
稀酸性KMnO4溶液颜色______
?
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是????????
???????????。
②装置图中C的作用是?????????????????。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是?????????????????????????????????????
4、选择题 用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
| 选项 | 操作及现象 | 溶液
A
通入CO2,溶液变浑浊,继续通入CO2至过量,沉淀不消失.
饱和Na2CO3溶液
B
通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.
Na2SiO3溶液
C
通入CO2,溶液变浑浊,继续通入CO2至过量,沉淀不消失.再加入品红溶液,红色褪去.
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊.
Ca(OH)2溶液
A.A
B.B
C.C
D.D
5、实验题 (1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。请完成相关的实验步骤和现象。可选试剂:①0. 1mol·L-1KI溶液;②0. 1mol·L-1FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L-1 KI溶液,再滴加5~6滴0. 1mol·L-1FeCl3溶液;
②充分反应后,将溶液分成三份;
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂____________,现象_______________,说明______________________。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察_______________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是______________________。
|
|