微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下,下列各组离子在指定溶液中可能大量共存的是
A.在碱性溶液中:K+、Cl-、Na+、CO32-
B.在c(H+)/ c(OH-)=1×10-12的溶液中:Ca2+、Cl?-、K+、NH4+
C.澄清透明溶液中:Cu2+、Fe3+、I-、SO42-
D.与铝粉反应放出氢气的无色溶液中:K+、NO3-、Cl-、HCO3-
参考答案: A
本题解析:
试题分析:A、在碱性溶液中:K+、Cl-、Na+、CO32-均可以大量共存,A正确;B、在c(H+)/ c(OH-)=1×10-12的溶液中根据水的离子积常数可知,溶液中在c(H+)=1×10-13mol/L,即溶液显碱性,因此Ca2+、NH4+不能大量共存,B不正确;C、Cu2+、Fe3+与I-均发生氧化还原反应而不能大量共存,C不正确;D、与铝粉反应放出氢气的无色溶液可能显酸性,也可能显碱性,如果显碱性,HCO3-不能大量共存,如果显酸性HCO3-也不能大量共存,且在酸性溶液中NO3-与铝反应
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙呈红色的溶液中:K+、AlO2-、NO3-、CO32-
B.c(ClO-)=1.0 mol·L-1溶液:Na+、SO32-、S2-、Cl-
C.水电离出来的c(H+)=1×10-12的溶液:K+、NH4+、SO42-、Fe3+
D.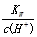 =0.1 mol·L-1的溶液:Na+、AlO2-、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、AlO2-、CO32-、NO3-
参考答案:D
本题解析:
试题分析:A.使甲基橙呈红色的溶液为强酸性溶液,酸性条件下AlO2-和CO32-均不会大量共存于溶液中,则A项错误;B项ClO-为强氧化性离子,能将SO32-、S2-氧化,故不可大量共存于溶液中,故B项错误;C项水电离出来的c(H+)=1×10-12的溶液,溶液中水电离出的c(H+)=1×10-12,故该溶液抑制了水的电离,则该溶液为酸或碱,当该溶液为酸时,各离子不发生化学反应,故可大量共存于溶液中,当该溶液为碱时,NH4+、Fe3+与OH—不会大量共存于溶液中,故C项错误;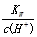 =0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、AlO2-、CO32-、NO3-不发生化学反应,故可大量共存于溶液中,故D项正确;本题选D。
=0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、AlO2-、CO32-、NO3-不发生化学反应,故可大量共存于溶液中,故D项正确;本题选D。
考点:离子大量共存问题。
本题难度:困难
3、选择题 下列各组离子因发生水解反应而不能大量共存的是
A.Ba2+、Cl-、Na+、SO42-
B.AlO2-、K+、HCO3-、Cl-
C.OH-、Fe3+、NO3-、SO42-
D.Al3+、Na+、HCO3-、Cl-
参考答案:D
本题解析:
试题分析:A项Ba2+和SO42-因生成沉淀不能大量共存,B项AlO2-和HCO3-因为发生强酸制弱酸反应不能大量共存,C项OH-和Fe3+因为生成沉淀不能大量共存,D项Al3+和HCO3-因为发生双水解反应不能大量共存。答案选D。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如
本题难度:一般
4、选择题 下列溶液中,微粒的浓度关系正确的是
A.0.1mol·L-1 pH为4的NaHSO3溶液中:c(HSO3―) > c(SO32―)> c(H2SO3)
B.等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F―)+c(HF)
C.在NaHA溶液中一定有:c(Na+)+c(H+) = c(HA―)+c(OH―)+c(A2-)
D.c(NH4+)相等浓度的(NH4)2CO3、(NH4)2SO4和(NH4)2Fe(SO4)2三份溶液物质的量浓度依次增大
参考答案:A
本题解析:A、HSO3-的电离程度大于水解程度,故A正确
B、F-+H2O HF+OH―,HF
HF+OH―,HF H++F-,二者混合2c(
H++F-,二者混合2c(
本题难度:一般
5、选择题 向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是[???? ]
A.K+、Br-、CO32-
B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42-
D.Ag+、Cu2+、NO3-
参考答案:A
本题解析:
本题难度:一般