微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
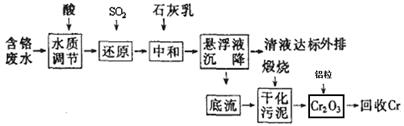
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是: ??????????????????????。
??????????????????????。
(2)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式k=????????????,若继续加水稀释,平衡将????移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式k=????????????,若继续加水稀释,平衡将????移动(填“正向”、“逆向”“不”)。
(3)请写出通入SO2时发生的离子反应:?????????????????????????。
(4)写出加入铝粒时发生反应的化学方程式???????????????,该反应是焓?????(填“增加”或“减少”)反应。
II.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成份。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其它成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(5)铬渣烧结炼铁法中煤粉的作用是??????????????????????????????????。(写两点)
(6)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2—+□H2O=□Cr(OH)3+□S2O32—+□OH—
参考答案:(1)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,
本题解析:(1)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据。
(2)水为纯液体,浓度为常数,在平衡常数表达式中不出现;加水稀释,使c(Cr2O72-)、c(CrO42-)、c(H+)均减少,该反应的浓度商公式中,分子减少的更快,使浓度商<平衡常数,平衡正向移动。
(3)根据流程图分析Cr2O72-转化为Cr3+,SO2一般是转化为SO42-,根据化合价升降法配平方程式。
(4)铝热反应是
本题难度:困难
2、选择题 在指定环境中,下列各组离子可以大量共存的是
[???? ]
A.无色溶液中:[Ag(NH3)2]+、K+、H+、NO3-
B.滴加酚酞试液仍无色的溶液中:CO32-、K+、ClO-、AlO2-
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、Cl-、K+
D.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、 SO42-
参考答案:C
本题解析:
本题难度:一般
3、填空题 (Ⅰ)(6分)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜? ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)(4分)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,??
A处的刻度为25,滴定管中液面读数应为 mL。

(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:??
实验次数
| 第一次
| 第二次
| 第三次
|
消耗NaOH溶液体积/mL
| 26.02
| 25.35
| 25.30
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,
其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= ???? 。
(Ⅲ)(15分)
已知:在25时H2O H++OH- KW=10-14 CH3COOH H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5 H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)
的比值 ?? (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将
(填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠
的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系
为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 ?????? 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH{溶液V2 mL。混合而得,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中
???????????能生成沉淀,原因是 ????????????????????????????
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= ??? 。
参考答案:(Ⅰ)⑤⑦⑧;③;②;(每空2分)
(Ⅱ)
(1
本题解析:
该题考查的是电解质溶液,包含它的电离与水解,这部分内容的题较难,它的难在于弱电解质、水解及沉淀溶解都是可逆的,所以它涉及到化学平衡方面的内容,考查范围较广。
(Ⅰ)、(Ⅱ)较简单,这里不再赘述,不过我认为(Ⅱ)第3小题的答案有误,答案应该是
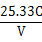
(Ⅲ)
(1)??????????醋
本题难度:一般
4、选择题 某无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:
⑴ 取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
⑵ 在⑴所得溶液中加入过量溶液,有气体生成,同时析出白色沉淀甲;
⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时析出白色沉淀乙。
则下列离子在原溶液中一定存在的有
A.SO42-、AlO2─、Na+、CO32─
B.Na+、CO32─、AlO2─
C.CO32─、Na+、Al3+
D.MnO4─、Na+、CO32─
参考答案:B
本题解析:
试题分析:无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。可以排除MnO4─这个有色离子,适量溶液,加入过量盐酸,有气体生成,并得到无色溶液,确定有CO32─离子,排除Ag+ Ba2+、Al3+离子,此时体系中还有Na+、AlO2─、CO32─、SO42─,依据电荷守恒,体系中一定存在Na+,在酸过量时AlO2─转化为Al3+,不能排除AlO2─离子的存在,在⑴所得溶液中加入过量NH4HCO3溶液,也就是发生如下反应,Al3++3HCO3-===Al(OH)3↓+3CO2↑,故气体是二氧化碳,沉淀是Al(OH)3,在⑵所得溶液中肯定含有NH4HCO3溶液,加入过量Ba(OH)2溶液并加热也有气体生成是氨气,同时析出白色沉淀乙应该是碳酸钡沉淀。
考点: 离子反应 有条件的离子共存
点评:本题主要考查的是离子反应及其共存的问题,需要大家了解常见的离子反应及其现象,并且能够通过题目所给的条件及其离子之间的内在逻辑关系,肯定哪些离子的同时否定哪些离子存在,进而得出结论。
本题难度:一般
5、填空题 (14分)某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
阳离子
| K+ Ag+ Mg2+ Cu2+ Al3+ NH4+
| 阴离子
| Cl- CO32- NO3- SO42- SiO32- I-
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为 。
参考答案:(14分,每空2分)(1)K+、NH4+ Cu2
本题解析:
试题分析:(1)Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。由于Cu2+的水溶液是蓝色的,在无色溶液中不能大量存在Cu2+;还可能含有Ag+、Mg2+、Al3+中至少一种离子;而且溶液中无NH4+存在;Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。说明无K+;因此根据I、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+ Cu2+ ;(2)Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。说明溶液中含有NO3-及还原性微粒I-;由于元素大量产生的离子会和Ag+、SiO32-发生沉淀反应形成AgCl沉淀、H2SiO3沉淀,因此无Ag+、SiO32-;二者发生氧化还原反应产生NO;NO与O2反应产生NO2;反应的离子方程式是:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,证明含有SO42-;由于原溶液中各种离子的浓度都是0.1mol/L,而且溶液应该呈电中性,所以阳离子为Mg2+, Al3+; 阴离子是Cl-, SO42-, NO3-;I-;由于酸都是强酸,而金属阳离子都是弱碱的金属阳离子,金属阳离子方程式水解反应消耗水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时,溶液中c(H+)>c(OH-)原溶液应该呈酸性,原因用离子方程式是Mg2++2H2O Mg(OH)2+2H+ ; Al3++3H2O Mg(OH)2+2H+ ; Al3++3H2O Al(OH)3+3H+。(4)Cu与稀硝酸反应的离子方程式是:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O;若使溶液中Cu2+的物质的量浓度最大,则n(H+):n(NO3-)=8:2,则n(H2SO4):n(HNO3)=[(8-2)÷2]:2=3:2。 Al(OH)3+3H+。(4)Cu与稀硝酸反应的离子方程式是:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O;若使溶液中Cu2+的物质的量浓度最大,则n(H+):n(NO3-)=8:2,则n(H2SO4):n(HNO3)=[(8-2)÷2]:2=3:2。
考点:考查守恒方法在溶液成分的确定的应用、离子存在的鉴定、混合溶液的计算的知识。
本题难度:困难
|
|