微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 V?L硫酸铝溶液中含Al3+的质量为m?g,则溶液中SO42-的物质的量浓度为
A.mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:B
本题解析:分析:硫酸铝的化学式为Al2(SO4)3,由n= 先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c=
先计算Al3+的物质的量,由化学式中离子的关系可确定SO42-的物质的量,然后利用c= 来计算SO42-的物质的量浓度.
来计算SO42-的物质的量浓度.
解答:Al3+的物质的量为 =
= mol,
mol,
由硫酸铝的化学式为Al2(SO4)3,
则SO42-的物质的量为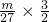 mol=
mol=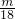 mol,
mol,
则溶液中SO42-的物质的量浓度为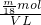 =
=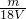 mol?L-1,
mol?L-1,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、体积、浓度的关系即可解答,本题的难点是利用铝离子的质量来计算离子的物质的量,将电子的质量忽略不计来分析解答.
本题难度:一般
2、填空题 (1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难______而易______.有机化工厂附近严禁火种,这是因为绝大多数有机物______.
(2)为了检验和除去下表中的各种物质中的杂质(括号里的物质),请从( I)中选出适当的检验试剂,从( II)中选出适当的除杂试剂,将所选的答案填入相应的空格内.
( I)检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶液C.盐酸D.氢氧化钠溶液
( II)除杂试剂:a.硫酸??b.酸性高锰酸钾溶液??c.新制的生石灰d.溴水
| 物质 | 检验试剂 | 除杂试剂
甲烷(乙烯)
酒精(水)
参考答案:(1)大多数有机物难溶于水,易溶于有机溶剂,动、植物油属于油
本题解析:
本题难度:简单
3、选择题 下列物质的鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl和K2SO4
B.用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液
C.利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液
D.用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液
参考答案:A
本题解析:
试题分析:A项:焰色反应是体现元素的物理性质,由于后两种物质都有K元素,因此无法用焰色反应鉴别出来,故错。故选A。
点评:本题以物质的鉴别来考查无机反应的知识,考查学生对基础知识的掌握程度,题目较易。
本题难度:一般
4、选择题 下列涉及有机化合物的分离提纯的说法正确的是
A.除去乙烷中混有的乙烯,可将混合气体通过酸性高锰酸钾溶液
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.除去溴苯中混有的Br2,可用NaOH溶液洗涤分液
D.乙酸乙酯中的少量乙酸和乙醇可用氢氧化钠溶液除去
参考答案:C
本题解析:
试题分析:A不正确,因为酸性高锰酸钾溶液能把乙烯氧化生成CO2,应该用溴水;石油分馏得不到甲烷、乙烯和苯,B不正确;苯和氢氧化钠溶液不反应,但溴可以溶解在氢氧化钠溶液中,C正确;氢氧化钠能使乙酸乙酯水解,D不正确,应该用饱和碳酸钠溶液,答案选C。
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
5、填空题 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:
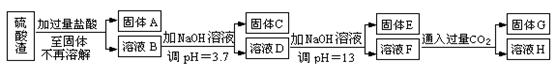
查资料得知:
物质名称
| 溶度积(Ksp)
| pH值
| 开始沉淀
| 完全沉淀
| Mg(OH)2
| 5.6×10-12
| 9.3
| 10.8
| Fe(OH)3
| 2.8×10-16
| 2.7
| 3.7
| Al(OH)3
| 1.3×10-33
| 3.7
| 4.7
?
请回答下列问题:
(1)写出固体A的化学式为??????????。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是??????。
A.石蕊试液???? B.广泛pH试纸??? C.精密pH试纸??? D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E?????;??????②溶液F生成固体G??????。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为?????。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)=??????。
参考答案:(1)SiO2(2分)
(2)CD(2分)
(3
本题解析:
试题分析:(1)第一步中加过量盐酸,Fe2O3、Al2O3、MgO与盐酸反应溶解,SiO2不溶过滤可得;(2)A、只能判断溶液的酸碱性,错误;B、广泛pH试纸 只能精确到整数,错误;精密pH试纸 和pH计读数能精确的小数点后一位或更多;(4)流程中得到的固体为氢氧化物,加热灼烧可得氧化物;
(5)溶液H为调节pH=13后得到的溶液,c(OH-)=0.1 mol/L
c(Mg2+)= Ksp÷c2(OH-)= 5.6×10-12÷0.12=5.6×10―10mol/L
本题难度:一般
|
|