微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:
c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比为
A.1∶1
B.5∶16
C.2∶3
D.3∶2
参考答案:B
本题解析:
试题分析:设Fe(NO3)2的物质的量是3mol,则Fe(NO3)3的物质的量是2mol,则该反应中参加反应的Fe的物质的量是5mol,未被还原的硝酸的物质的量是12mol,失去电子的物质的量是3mol×2+2mol×3=12mol,则被还原的硝酸的物质的量是12mol/3=4mol,所以参加反应的硝酸的总物质的量是12+4=16mol,所以参加反应的Fe和HNO3的物质的量之比为5:16,答案选B。
考点:考查硝酸与铁反应的计算
本题难度:一般
2、选择题 下列反应中水作为氧化剂的是(???)
A.Cl2+H2O="HCl" +HClO
B.3Fe+4H2O(g)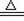 Fe3O4+4H2
Fe3O4+4H2
C.2F2+2H2O=4HF+O2
D.3NO2+H2O=2HNO3+NO
参考答案:B
本题解析:
正确答案:B
A、水中元素化合价不变;B、水中氢元素化合价降低,作氧化剂;C、水中氢元素化合价升高,作还原剂;D、水中元素化合价不变。
本题难度:一般
3、计算题 (6分)用MnO2和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则
(1)制氯气的反应中转移了多少个电子?
(2)生成多少升氯气?
可制得漂白粉多少克?
参考答案:(1)2.048×1023
本题解析:
试题解析:(1)MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓)
MnCl2+Cl2+2H2O↑,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为2.048×1023个;(2)在MnO2+4HCl(浓) MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;
MnCl2+Cl2+2H2O↑反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g。
考点:电子转移数目、化学方程式的计算
本题难度:一般
4、选择题 下列标示物质结构的化学用语正确的是

参考答案:D
本题解析:A 错误,表示的是6个中子的碳原子
B 错误,HF是共价化合物,不存在阴阳离子
C 氯离子质子数是17,不是18
D 正确。
本题难度:一般
5、选择题 不属于氧化还原反应的是
A.2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
B.2Mg+CO2 2MgO+C
2MgO+C
C.N2+3H2 2NH3
2NH3
D.SiO2+CaO CaSiO3
CaSiO3
参考答案:D
本题解析:略
本题难度:简单