微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围 ;
②若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
2、选择题 下列有关物质的表达式正确的是 (????)
A.乙炔分子的比例模型示意图:
B.溴乙烷的电子式: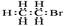
C.乙醇的结构简式:CH3CH2OH
D.1,3-丁二烯的分子式:C4H8
3、选择题 1966年,范克等人提出热化学循环制氢法:
2H2O(1)+SO2(g)+I2(s)
298k
H2SO4(aq)+2HI(g)
H2SO4(aq)1073k
H2O(1)+SO2(g)+1
2
O2(g)
2HI(g)873k
H2(g)+I2(g)
从理论上讲,该循环中,1molH2O能制氢气( )
A.0.25mol
B.0.5mol
C.1mol
D.2mol
4、填空题 已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
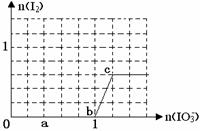
(1)写出a点反应的离子方程式??????????????????????????;
反应中还原剂是????????;被还原的元素是????????。
(2)写出b点到c点反应的离子方程式?????????????????????。
(3) 当溶液中的I-为0.4 mol时,加入的KIO3为????????????mol。 当溶液中的I-为0.4 mol时,加入的KIO3为????????????mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
??????????????????????????????????????????????????。
5、填空题 已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题: CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
|
网站客服QQ: 960335752 - 14613519 - 791315772