微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ="====" 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
2、选择题 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)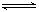 SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是(?)
SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是(?)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
3、填空题 (6分)在一容积为2L且容积不变的密闭容器中加入适量碳粉和0.2molH2O。在800℃条件下,经20s后达到如下化学平衡:C(s) +H2O(g)  CO(g) + H2(g);△H=" -Q" kJ·mol-1(Q>0)。已知达到平衡时,CO为0.12mol。试回答:
CO(g) + H2(g);△H=" -Q" kJ·mol-1(Q>0)。已知达到平衡时,CO为0.12mol。试回答:
(1)其他条件不变,若加入少量碳,则平衡移动情况是:________________;
(2)若用υ(H2O)表示该反应前20s内的平均速率,则υ(H2O)=" ________________?" ;
(3)若向上述平衡的混合物中再充入0.08mol H2,在相同条件下达到新的平衡,此时CO的物质的量为________________mol。
4、选择题 加热N2O5依次发生的分解反应为:
①N2O5(g)  N2O3(g)+O2(g)??????②N2O3(g)
N2O3(g)+O2(g)??????②N2O3(g)  ?N2O(g)+O2(g)
?N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
A.1.8mol/L
B.0.9 mol/L
C.2.3 mol/L
D.4.0 mol/L
5、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液) 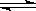 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色???????????????????黄色
浓度为0.02 mol·L-1的下列各溶液
①盐酸②石灰水③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液 ?⑥氨水
?⑥氨水
其中能使指示剂显红色的是
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑥