微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在反应3S+6KOH=2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫的质量比为( )
A.2:1
B.1:2
C.3:1
D.1:3
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下列有关化学用语表示正确的是
A.中子数为20的氯原子: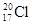
B.CO2的比例模型:
C.铝原子的结构示意图: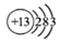
D.聚丙烯的结构简式: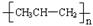
参考答案:C
本题解析:
试题分析:A、中子数为20的氯原子,质量数是37,所以应表示成: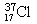 1737Cl
1737Cl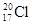 ,错误;B、二氧化碳分子中,
,错误;B、二氧化碳分子中,
本题难度:简单
3、实验题 (16分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移
的方向和数目 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂。

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数
| 1
| 2
| 3
| 4
|
KMnO4溶液体积/mL
| 20.60
| 20.02
| 20.00
| 19.98
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(结果保留4位有效数字)
参考答案:(1) 本题解析: 本题解析:
试题分析:Ⅰ 、(1)由装置图可知装置A发生反应为浓硝酸与C的反应: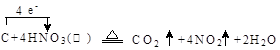 ;(2)B装置的作用是:3NO2+H20=2HNO3+NO,后Cu与稀HNO3反应产生NO,故装置B作用为制取NO;(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为: ;(2)B装置的作用是:3NO2+H20=2HNO3+NO,后Cu与稀HNO3反应产生NO,故装置B作用为制取NO;(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为: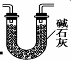 或 或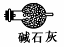 ;(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1-2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;Ⅱ、(5)由题中所给数据可知第一组数据明显偏大,根据 ;(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1-2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;Ⅱ、(5)由题中所给数据可知第一组数据明显偏大,根据 可知A项酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会是所测V(标准)偏大,故会导致所得结果偏大,故A项正确;B项锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;C项滴定终了仰视读数,则会导致V(标准)偏大,故会导致所得结果偏大,故C项正确;D项滴定终了俯视读数,则会导致V(标准)偏小,故会导致结果偏低,故D项错误;本题选AC;(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数= 可知A项酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会是所测V(标准)偏大,故会导致所得结果偏大,故A项正确;B项锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;C项滴定终了仰视读数,则会导致V(标准)偏大,故会导致所得结果偏大,故C项正确;D项滴定终了俯视读数,则会导致V(标准)偏小,故会导致结果偏低,故D项错误;本题选AC;(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数=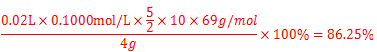 。 。
考点:化学综合实验。
本题难度:困难
4、选择题 下列反应或过程一定不是氧化还原反应的是(????)??
A.ΔH<0 的反应
B.古人用热分解法制水银
C.用明矾净水
D.实验室用浓盐酸和MnO2制Cl2
参考答案:C
本题解析:
试题分析:氧化还原反应可以是放热反应;单质银可用热分解氧化银来制备,属于氧化还原反应;明矾净水用的是铝离子水解反应生成的氢氧化铝吸附作用净水,因此C中没有氧化还原反应发生;D中用浓盐酸制备氯气是氧化还原反应,故选C。
本题难度:一般
5、填空题 在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的 材料;硅酸钠水溶液俗称为 ,是制备硅胶和木材防火剂的原料;陶瓷、 、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是 ;漂白液有效成分的化学式为 。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:
②NO2气体通入水中:
③水既作氧化剂又作还原剂:
参考答案:(1)半导体 水玻璃 玻璃
(2
本题解析:
试题分析:(1)晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅酸钠水溶液俗
称为水玻璃,陶瓷、玻璃、水泥是使用量最大的无机非金属材料;
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,其中漂白液有效成分是次氯酸钠,化学式为NaClO;
(3)①水只作氧化剂:钠与水的反应、铁与水蒸气的反应、碳与水蒸气的反应等,
②NO2气体通入水中生成硝酸和一氧化氮,化学方程式为3NO2+H2O 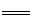 2HNO3+NO, 2HNO3+NO,
③水既作氧化剂又作还原剂,水的电解,2H2O  2H2↑+O2↑ 2H2↑+O2↑
考点:考查物质的俗称、无机非金属材料、硅的用途的判断,漂白粉的生成,化学方程式的书写
本题难度:一般
|