微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是
A.25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同
B.25℃时,Ksp(A)> Ksp(B),说明化合物A的溶解度比化合物B的大
C.常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-)
D.在NH4Cl溶液中加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1
参考答案:CD
本题解析:
试题分析:由于盐酸是酸,而氨水是碱,故两者都是抑制水的电离,所以25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度是相同的,故A错误;溶解度的大小与溶度积没有必然的联系,故.25℃时,Ksp(A)> Ksp(B),不能确定化合物A的溶解度比化合物B的大,故B错误;常温下pH=4的盐酸中,根据电荷守恒可以得到,c(H+)=c(OH-)+c(Cl-),故C正确;NH4Cl为强酸弱碱盐,其水溶液中由于铵根离子的水解而呈酸性,加入硫酸可以抑制其铵根离子的水解,所以加入适量硫酸,可使c(NH
本题难度:简单
2、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)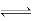 Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
A.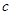 (Ca2+)增大
(Ca2+)增大
B. (Ca2+)不变
(Ca2+)不变
C.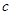 (OH—)增大
(OH—)增大
D. (OH—)减小
(OH—)减小
参考答案:D
本题解析:
试题分析:题目中Ca(OH)2溶液是饱和溶液,加入生石灰发生:CaO+H2O=Ca(OH)2,减少水的量,使溶质析出,n(Ca2+)、n(OH-)减少,剩下的溶液仍然是饱和溶液,c(Ca2+)、c(OH-)不变,选项D正确。
考点:考查难容电解质的溶解平衡。
本题难度:一般
3、选择题 查阅资料得知Fe3+、Mg2+、Al3+在浓度均为0.1mol·L-1时,氢氧化物沉淀的pH如下表:
氢氧化物
| Fe(OH)3
| Mg(OH)2
| Al(OH)3
|
开始沉淀的pH
| 2.3
| 10.8
| 3.7
| 开始溶解的pH:7.8
|
完全沉淀的pH
| 4.3
| 12.4
| 5.2
| 完全溶解的pH:10.0
??????若要从含Fe3+、Mg2+、Al3+的混合溶液中,只得到Fe(OH)3沉淀,则应调节溶液的pH范围A.12.4~14????????? B.7.8~10.0??????? C.10.0~10.8???????? D.3.7~5.2
参考答案:C
本题解析:根据表中数据可知当要使铁离子完全沉淀,其pH要大于4.3,但此时铝离子也开始沉淀。由于氢氧化铝是两性氢氧化物,根据数据可知当pH大于10.0氢氧化铝即完全溶解。而氢氧化镁只有当pH大于10.8时才能形成沉淀,所以应控制的pH范围是10.0~10.8。答案选C。
本题难度:一般
4、填空题 将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
参考答案:
①>⑥>⑤>②=③>④
本题解析:
在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)
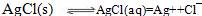
(注:s表示为溶解的固体,aq表示已被溶解,但未电离的AgCl)
当溶液中存在Ag+或者
本题难度:简单
5、填空题 (16分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”),测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
(2)有关①100mL0.1 mol·L-1NaHCO3、 ②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A.NaHCO3溶液中:c (H+)+c (Na+)=" c" (HCO3-)+2c(CO32-)+c(OH-)
B.Na2CO3溶液中:2c (Na+)=" c" (HCO3-)+c(CO32-)+c(H2CO3)
C.①溶液中:c(CO32-)>c(H2CO3)
D.②溶液中:c(HCO3-)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:
c(Na+)=c(Cl-)+c(HCO3-)+2c(CO32-),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积 10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
参考答案:21.(16分) (每空2分)
(1)大于
本题解析:
试题分析:(1)组成盐的酸根对应的酸越弱,该盐的水解程度越大,等浓度、等体积的Na2CO3和NaHCO3混合液中,碳酸根的水解程度大于碳酸氢根的水解程度,水解程度越大,碱性越强,PH越大,Na2CO3、NaHCO3的pH分别为a和b,则a大于b,测定溶液的pH值基本操作为用镊子撕一块试纸放在干净的表面皿上,用玻璃棒蘸取待测液,滴在试纸的中央,变色后与标准比色卡对比,读出PH值,则所用的主要仪器有:pH试纸、表面皿、玻璃棒和标准比色卡。
(2)A.NaHCO3溶液中存在电荷守恒,为c (H+)+c (Na+)=" c" (HCO3-)+2c(CO32-)+c(OH-),正确;B.Na2CO3溶液中存在物料守恒为c (Na+)=" 2c" (HCO3-)+2c(CO32-)+2c(H2CO3),错误;C.NaHCO3溶液显碱性,HCO3-水解程度大于其电离程度,水解产生H2CO3,电离产生CO32-,所以c(CO32-)<c(H2CO3) ,错误;D.碳酸钠溶液,阴离子分步水解,第一步水解程度(生成HCO3-)大于第二步水解程度(生成H2CO3),所以:c(HCO3-)>c(H2CO3),正确;选BC。
(3)由于CO32- + H2O  HCO3-+OH-,CO32-水解导致碳酸钠溶液显碱性,滴加酚酞试液,溶液变红色,继续滴加BaCl2溶液,发生Ba2+ +CO32-=BaCO3↓(白色沉淀),水解平衡逆向移动,碱性减弱,OH-浓度减少,红色褪去。 HCO3-+OH-,CO32-水解导致碳酸钠溶液显碱性,滴加酚酞试液,溶液变红色,继续滴加BaCl2溶液,发生Ba2+ +CO32-=BaCO3↓(白色沉淀),水解平衡逆向移动,碱性减弱,OH-浓度减少,红色褪去。
(4)任何溶液均呈电中性,根据电荷守恒,c(Na+)+c(H+)= c(Cl-)+c(HCO3-)+2c(CO32- )+c(OH-),已知溶液中存在c(Na+)= c(Cl-)+c(HCO3-)+2c(CO32-),所以c(H+)= c(OH-),此时溶液呈中性,往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl10mL,溶液恰好反应生成NaHCO3,碳酸氢钠溶液显碱性,若要使溶液呈中性,需多加盐酸,所以所用HCl的体积大于10mL。
(5)将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,设体积为1L,发生反应Na2CO3 +CaCl2=CaCO3↓+2NaCl
0.2 0.2
剩余碳酸钠的物质的浓度为(0.4-0.2)/2=0.1mol/L,已知Ksp(CaCO3)=4.96×10-9,则0.1×c(Ca2+)= 4.96×10-9,解得c(Ca2+)= 4.96×10-8,则混合后溶液中Ca2+浓度为4.96×10-8mol·L-1。
考点:考查盐类水解PH值的判断,电解质溶液中的离子平衡,沉淀溶解平衡的应用等知识。
本题难度:困难
|