微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 根据反应8NH3 + 3Cl2 ="=" 6NH4Cl+ N2 ,回答下列问题:
(1) 还原剂是?????????(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为?????升。
参考答案:(1)NH3; (1分)?????(2)略; (2分)???
本题解析:略
本题难度:简单
2、选择题 已知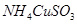 与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是(???)
与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是(???)
A.反应中硫酸作氧化剂
B.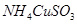 中硫元素被氧化
中硫元素被氧化
C.1mol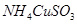 完全反应转移0.5mol电子
完全反应转移0.5mol电子
D.刺激性气味的气体是氨气
参考答案:C
本题解析:
试题分析:由题意知,发生的反应为2NH4CuSO3+2H2SO4=2(NH4)2SO4+CuSO4+Cu↓+2SO2↑2H2O.A、硫酸起酸性作用,错误;B、NH4CuSO3中铜元素发生自身氧化还原,所以铜元素被氧化,错误;C、由反应可知1mol NH4CuSO3完全反应转移0.5mol电子,正确;D、刺激性气味的气体是SO2,错误。
本题难度:简单
3、选择题 氰化物有剧毒,在碱性条件下可用如下方法进行处理:
2CN-+120H-+5Cl2=2CO32-+N2+10Cl-+6H20,则下列判断中,不正确的是
A.上述反应中的氧化剂是Cl2
B.该反应过程中只有氮元素被氧化
C.还原性:CN-> Cl-
D.当有1 molCl2参加反应时,转移的电子数为2mol
参考答案:B
本题解析:
试题分析:正确判断反应中变价元素的化合价,理清氧化还原反应的基本概念和基本规律是解题的关键。A、由题给反应知,氯元素的化合价由0价降低到-1价,得到电子作氧化剂,正确;B、该反应中,CN-中的碳元素的化合价由+2价升高到+4价,氮元素的化合价由-3价升高到0价,这两种元素均被氧化 ,错误;C、该反应中的还原剂是CN-,还原产物是Cl-,所以还原性CN->Cl-,正确; D、由题给反应知,氯元素的化合价由0价降低到-1价,当有1 molCl2参加反应时,转移的电子数为2mol,正确。
本题难度:一般
4、选择题 下列物质,能因强氧化性而使品红溶液褪色的是(???)。
①干燥的C12?②Na2O2?③NaClO?④活性炭?⑤HClO ⑥SO2
A.除①以外
B.除③以外
C.①②③⑤
D.全部可以
参考答案:C
本题解析:①②③⑤均是或可以形成强氧化物质,使品红溶液褪色,而活性炭只具有物理吸附作用,SO2具有漂白性而使其褪色,故答案为C
本题难度:简单
5、填空题 (7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
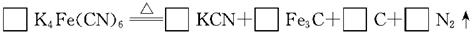
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有___???????????????????????___(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为____??????__mol。
参考答案:(7分)⑴不是(1分) ⑵3,12,1,5,3(2分)⑶①F
本题解析:(1)f反应中元素的化合价都没有发生变化,所以不是氧化还原反应。
(2)根据原子守恒可以进行配平。
(3)化合价升高的元素是铁元素、碳元素和氮元素,所以氧化产物是Fe(SO4)3 、HNO3、CO2。1mol K4Fe(CN)6在反应中失去电子是(1+2×6+8×6)mol=61mol,所以根据电子的得失守恒可知,消耗高锰酸钾的物质的量为61mol÷5=12.2mol.
本题难度:一般