微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 PbO2受热分解为+4和+2价的Pb的混合氧化物, +4价的Pb能氧化浓盐酸生成Cl2 ,现将1molPbO2加热分解得到O2 ,再向残余固体中加入过量的浓盐酸得到Cl2 , O2和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是
A.2:1混合的Pb3O4、PbO
B.1:4:1混合的PbO2、Pb3O4、PbO
C.1:2混合的PbO2、Pb3O4
D.1:1:4混合的PbO2、Pb3O4、PbO
2、选择题 下列说法正确的是
A.MnO2+4HCl MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4
B.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
C.3S+ 6KOH ="2K2S+" K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2:1
D.5NH4NO3=4N2+2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮元素物质的量之比为5:3
3、选择题 依据离子反应:1N2H5++4Fe3+===4Fe2++aY+……(a是配平后Y的系数),在水溶液中N2H5+将Fe3+还原为Fe2+,则N2H5+被氧化后的产物Y可能是?????????????(?)
A.N2
B.H2
C.NH3
D.NO
4、选择题 有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为
A.1∶1
B.3∶1
C.5∶1
D.7∶1
5、填空题 高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
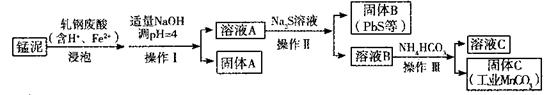
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中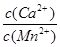 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]