微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:

反应中___________ 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)类似,化学上称为拟卤素。[如:(SCN)2+H2O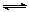 HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
①(CN)2与KOH溶液反应的化学方程式;
②NaBr与KSCN的混合物中加入(CN)2的离子方程式。
参考答案:(1)2? 4? 4? 2? 1?锰
(2)①(CN)
本来源:www.91exam.org题解析:(1)为氧化还原反应配平题。此题重点在于找准F、Mn、Sb元素的化合价,关键是F的价态。F在化合物中一定为-1价,由此确定K2MnF6中Mn为+4价,反应后在MnF3中为+3价。SbF5中Sb为+5价,而在KSbF6中Sb为+5价。然后用化合价升降法配平即可。
(2)为信息题,解题抓住两条信息,一是(CN)2、(SCN)2与X2很相似,解题时看成Cl2;二是阴离子还原顺序为Cl-<Br-<CN-<SCN-<I-。由此可得②小题答案,即(CN)2只能氧化SCN-而不能氧化Br-。
本题难度:一般
2、选择题 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L
B.13.5L
C.15.7L
D.16.8L
参考答案:A
本题解析:若混合物全是CuS,其物质的量为12/80=0.15mol,根据得失电子数相等:0.15×(6+2)=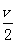 ×22.4×3+
×22.4×3+ 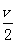 本题难度:一般
本题难度:一般
3、选择题 某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是?
A.消耗硫酸亚铁铵的物的质量为n(2-x)mol
B.处理废水中Cr2O72- 的物质量为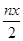 mol
mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y
参考答案:A
本题解析:
试题分析:A、由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),由得失电子守恒得3x=y,代入得硫酸亚铁铵的物的质量为n(3x+1)mol,错误; B、根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为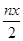 mol,正确;C、得到nmolFeO?FeyCrxO3,则一共有nxmolCr原子
mol,正确;C、得到nmolFeO?FeyCrxO3,则一共有nxmolCr原子
本题难度:一般
4、选择题 某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是:

A.该反应的还原剂是Cl—
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
参考答案:D
本题解析:方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,由方程式可知反应的还原剂为NH4+,故A错误;N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,故B错误;由方程式可知氧化剂和还原剂的物质的量之比为3:2,故C错误;反应生成H+,溶液酸性增强,故D正确;故选D。
本题难度:一般
5、选择题 做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为MnO4—+H2C2O4+H+→CO2↑+Mn2++ ????。下列有关叙述正确的是(???)
A.发生还原反应的是H2C2O4
B.该离子方程式右侧方框内的产物是OH—
C.10mol CO2生成时,电子转移5 mol
D.1 mol乙二酸分子中含有7molσ键
参考答案:D
本题解析:
试题分析:高锰酸钾具有强氧化性,能把草酸氧化,则草酸发生氧化反应,高锰酸钾发生还原反应,A不正确;溶液是显酸性的,不可能生成碱,应该是水,B不正确;草酸中碳元素的化合价是+3价,反应后变为+4价,失去1个电子,则10mol CO2生成时,电子转移10 mol,C不正确;单键都是σ键,而双键中含有1个σ键和1个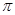 本题难度:一般
本题难度:一般