微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列家庭小实验不能成功的是(??????)
A.用食盐水除水垢
B.用加热的方法给聚乙烯塑料袋封口
C.用铅笔芯代替石墨试验导电性
D.用灼烧的方法区别羊毛线和棉线
参考答案:A
本题解析:A、水垢的主要成分为CaCO3等,可以用醋酸除去。食盐水为中性,不可以。
本题难度:简单
2、选择题 下列根据实验现象所作出的结论中一定正确的是
A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液
B.无色试液加入银氨溶液,加热出现银镜,结论:试液中含有醛类物质
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙
参考答案:C
本题解析:略
本题难度:简单
3、实验题 (12分)碱式碳酸镁[一般以xMgCO3?yMg(OH)2?zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:
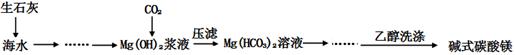
(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是:??????????????????。
②氢氧化镁浆液与CO2反应的化学方程式为:
????????????????????????????????????。
③碱式碳酸镁用乙醇洗涤的目的是:?????????????????????????????。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3?yMg(OH)2?zH2O  (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2?zH2O]的化学式(要求写出计算过程)。
参考答案:(1)①作燃料、提供能量??????????????(2分)
本题解析:
试题分析:(1)①CaCO3高温分解生成CaO和CO2,所以焦炭的作用是:作燃料、提供能量。
②根据流程图,CO2与Mg(OH)2反应后的产物经压滤得到Mg(HCO3)2,所以CO2与Mg(OH)2反应的化学方程式为:Mg(OH)2+2CO2 = Mg(HCO3)2
③因为碱式碳酸镁在水中引起轻微的碱性反应,不溶于乙醇,所以用乙醇洗涤可以除去表面杂质、减少固体的损耗。
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,可得:
n(Mg2+)=20.0g/40g·mol-1=0.5mol???(1分)
n(CO2)=17.6g/44g·mol-1= 0.4mol???(1分)
据元素守恒得:
m(MgCO3)=0.4mol×84g·mol-1=33.6g(1分)
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g(1分)
n(H2O)=44.6g-33.6g-5.8g/18g·mol-1=0.4mol(1分)
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3·Mg(OH)2·4H2O(1分)
本题难度:一般
4、填空题 (10分)为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为 23.3g,则原混合物中氯化钾的质量分数为______。
23.3g,则原混合物中氯化钾的质量分数为______。
参考答案:BaCl2;BaSO4;25.6g;玻璃棒;32%
本题解析:略
本题难度:一般
5、实验题 羧酸酯RCOOR′在催化剂存在时可跟醇R″OH发生如下的反应(R′,R″是两种不同的烃基):

此反应称为酯交换反应,常用于有机合成中。
在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
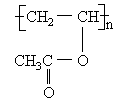
转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
(1)反应中甲醇为什么要过量?
答:_________________。
(2)写出聚乙烯醇的结构简式:_________________。
(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:_______。
参考答案:
(1)过量的甲醇使平衡向右移动,酯交换反应完全。
本题解析:本题是新信息题,其新信息是酯交换反应。分析新信息,可知R-为酯中羧酸部分的烃基,R′—为酯中醇部分的烃基,当酯RCOOR′与醇R″OH的反应时,醇烃基R″—取代酯中原有醇的烃基R′—而发生酯交换反应,用这种新获取的信息解决聚乙酸乙烯醇制取乙烯醇问题时,是聚乙酸乙烯酯跟甲醇进行酯交换,即n个CH3—OH中的n个—CH3和聚乙酸乙烯酯中的n个—CH=CH2进行交换生成聚乙烯醇:
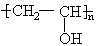
本题难度:一般