微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式:???????????????????????。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为???????????????????????。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO32-和N2,其离子方程式为???????????????????????。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是???????????????????。
参考答案:(1)HCN 本题解析:(1)HCN的水溶液酸性很弱,说明HCN为弱电解质,电离方程式为HCN
本题解析:(1)HCN的水溶液酸性很弱,说明HCN为弱电解质,电离方程式为HCN H++CN-;(2)[Au(CN)2]-两步电离方程式分别为[Au(CN)2]-
H++CN-;(2)[Au(CN)2]-两步电离方程式分别为[Au(CN)2]- 本题难度:一般
本题难度:一般
2、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正确的是
 [???? ]
[???? ]
A.MOH和ROH都是强碱
B.稀释前,c(ROH)= 10c(MOH)
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,c(M+)=c(R+)
参考答案:D
本题解析:
本题难度:一般
3、选择题 9.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离的c(H+)的106倍
参考答案:B
本题解析:
试题分析:A项HA电离出的c(H+)为0.1mol/L×0.1%=10-14 mol/L,则pH=-lg(10-4)=4;B项温度升高,促进弱电解质的电离,H+浓度变大,那么pH变小;C项由HA=H++A-知,c(H+)= c(A-)=10-14 mol/L,则电离平衡常数为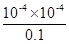 =10-7;D项HA电离出的c(H+)为0.1 mol/L×0.1%=10-14 mol/L,水电离产生的c(H+)=10-10 mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍。
=10-7;D项HA电离出的c(H+)为0.1 mol/L×0.1%=10-14 mol/L,水电离产生的c(H+)=10-10 mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查了弱酸的电离,明确离子浓度、温度对电离平衡的影响及离子积的计算时解答本题的关键。
本题难度:一般
4、选择题 下列物质属于电解质而且能导电的是?(??)
A.KNO3溶液
B.熔融的氯化钠
C.明矾晶体
D.氨
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列电离或水解方程式中,正确的是
A.CH3COOH=CH3COO-+H+
B.Br-+H2O  HBr+OH-
HBr+OH-
C.CO32-+2H2O  H2CO3+2OH-
H2CO3+2OH-
D.NH4++2H2O  NH3·H2O+H3O+
NH3·H2O+H3O+
参考答案:D
本题解析:
试题分析:A、醋酸是弱电解质,存在电离平衡,电离方程式应该是CH3COOH CH3COO-+H+,A不正确;B、氢溴酸是强酸,溴离子不水解,B不正确;C、碳酸是二元弱酸,CO32-水解分步进行,即CO32-+H2O
CH3COO-+H+,A不正确;B、氢溴酸是强酸,溴离子不水解,B不正确;C、碳酸是二元弱酸,CO32-水解分步进行,即CO32-+H2O 本题难度:一般
本题难度:一般